题目内容
16.以炼铅厂铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)为原料生产氯化锌的工艺流程如下: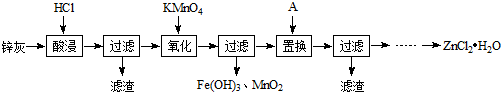
(1)“酸浸”时一般控制温度为30℃,温度不宜过高的原因是减少氯化氢的挥发.
(2)“氧化”时需控制溶液的pH为5.写出KMnO4氧化Fe2+为Fe3+的离子方程式MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O.实际生产中高锰酸钾用量远多于理论用量的原因是部分高锰酸钾氧化氯离子而消耗.
(3)物质A的化学式是Zn.
(4)写出流程中省略的操作步骤:蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干,若操作不当则会产生杂质Zn(OH)Cl,欲降低产品中该杂质的含量,可以采取的方法是控制蒸发时的温度不宜过高,或者向滤液中加入适量的盐酸.
分析 铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)加入盐酸酸浸,过滤后滤液中含有Zn2+、Fe2+、Mn2+等,加入高锰酸钾可生成Fe3+和MnO2,发生MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O,过滤后滤液中含有等Zn2+、Mn2+等,加入Zn置换出Mn,滤液中主要含有Zn2+,经蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干可得到ZnCl2•H2O,以此解答该题.
解答 解:铅锌烟灰(主要成分为ZnO,还含有少量Fe2+、Mn2+及微量其他重金属离子)加入盐酸酸浸,过滤后滤液中含有Zn2+、Fe2+、Mn2+等,加入高锰酸钾可生成Fe3+和MnO2,发生MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O,过滤后滤液中含有等Zn2+、Mn2+等,加入Zn置换出Mn,滤液中主要含有Zn2+,经蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干可得到ZnCl2•H2O,
(1)铅锌烟灰溶解在盐酸中,加热可促进溶解,但盐酸易挥发,应控制温度,故答案为:减少氯化氢的挥发;
(2)控制溶液的pH为5.写出KMnO4氧化Fe2+为Fe3+,同时生成MnO2,反应的方程式为MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O,由于溶液中含有氯离子,高锰酸钾可氧化氯离子而消耗,则实际生产中高锰酸钾用量远多于理论用量,
故答案为:MnO4-+3Fe2++4H+=3Fe3++MnO2↓+2H2O;部分高锰酸钾氧化氯离子而消耗;
(3)A用于置换Mn,为防止引入新杂质,应用锌,故答案为:Zn;
(4)滤液中主要含有Zn2+,经蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干可得到ZnCl2•H2O,如操作不当,则氯化锌水解生成Zn(OH)Cl,应控制蒸发时的温度不宜过高,或者向滤液中加入适量的盐酸,
故答案为:蒸发浓缩、冷却结晶,过滤,冰水洗涤,低温烘干;控制蒸发时的温度不宜过高,或者向滤液中加入适量的盐酸.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,题目考查较为全面,能较好的培养学生良好的科学素养,难度中等.

| A. | 乙醇、苯酚、硝基苯 | B. | 苯、乙醛、己烯 | ||
| C. | 甲酸、甲苯、乙酸 | D. | 苯乙烯、甲苯、环己烷 |
| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: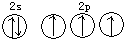 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |

已知吸收塔中反应后的铬元素以Cr3+形式存在,下列说法中正确的是( )
| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 原子的最外层电子数都是7个 | |
| C. | 它们的单质的颜色随核电荷数的增加而加深 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
 浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.