题目内容
2.某分子式为C3H5Cl的有机物同分异构体的数目为( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 根据化学式C3H5Cl可知,该化合物是含有碳碳双键的卤代烃,即相当于是丙烯中的1个氢原子被氯原子取代后的生成物,所以共计有3种.又因为1-氯-1丙烯存在顺反异构,所以总共是4种;也可以是环丙烷的一氯取代物.
解答 解:根据化学式C3H5Cl可知,该化合物是含有碳碳双键的卤代烃,即相当于是丙烯中的1个氢原子被氯原子取代后的生成物,所以共计有3种:CH2═CHCH2Cl、CHCl═CHCH3、CH2═CClCH3.又因为CHCl═CHCH3存在顺反异构,所以总共是4种,也可以是环丙烷的一氯取代物,共5种.
故选C.
点评 本题考查有机物的同分异构体的书写,难度不大,注意掌握同分异构体的书写方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列表示正确的是( )
| A. | 含有大量AlO2-的溶液中:K+、NH4+、Br-、HSO3-可以大量共存 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ•mol-1 | |
| C. | 将少量SO2通入NaClO溶液中:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 在某钠盐溶液中含等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但未见沉淀生成,则原溶液中一定有NO3-、I-和CO32- |
13.下列说法正确的是( )
| A. | 打开盛浓盐酸的试剂瓶可看到白色的酸雾,这说明HCl不稳定 | |
| B. | 蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸是氧化性酸 | |
| C. | 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| D. | 碳酸、亚硫酸和次氯酸都是不稳定性酸 |
10.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 84 g NaHCO3晶体中含有NA个CO32- | |
| B. | 室温下,14.0 g乙烯和丁烯的混合气体中含有C-H键数目为2.0NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| D. | 78 g Na2O2与足量的CO2反应,电子转移个数为2NA |
17.下列说法正确的是( )
| A. | 一氯代烷烃,随C原子数的增多,密度依次增大 | |
| B. | 常温下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 饱和一元羧酸,随C原子数的增多,酸性逐渐减弱 | |
| D. | 邻-二甲苯、间-二甲苯,对-二甲苯的沸点依次升高 |
14.碳及其化合物的开发利用已成为科学家研究的重要课题,在工农业生产和科学研究中有十分重要的地位.
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.

(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
(1)温度T2>T1的理由是甲乙两容器中反应物浓度相同,乙达到平衡所有时间短,说明T2温度高.
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.

(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
| 容积 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
11.下列反应属于氧化还原反应的是( )
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | ||
| C. | NH3+HCl═NH4Cl | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑ |
12.随着科技发展,新型电池层出不穷.图1为肼(N2H4)燃料电池,图2为光伏并网发电装置.LED(半导体照明)是由GaN芯片和钇铝石榴石(YAG,化学:Y3Al5O12)芯片装在一起而做成,其在运动会场馆内也随处可见.下列有关说法中正确的是( )
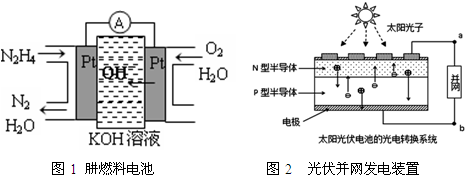

| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |