题目内容
10.用NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 84 g NaHCO3晶体中含有NA个CO32- | |
| B. | 室温下,14.0 g乙烯和丁烯的混合气体中含有C-H键数目为2.0NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| D. | 78 g Na2O2与足量的CO2反应,电子转移个数为2NA |
分析 A、NaHCO3晶体中无CO32-;
B、乙烯和丁烯的最简式为CH2;
C、粗铜中含有还原性强于铜的杂质铁、锌,电解过程中优先放电;
D、求出Na2O2的物质的量,然后根据过氧化钠与二氧化碳的反应为歧化反应来分析.
解答 解:A、NaHCO3晶体中为Na+和HCO3-,无CO32-,故A错误;
B、乙烯和丁烯的最简式为CH2,故14g混合气体中含有的CH2的n=$\frac{14g}{14g/mol}$=1mol,故含有的C-H键的物质的量为2mol,故个数为2NA个,故B正确;
C、电解精炼铜时,阳极粗铜中含有活泼性较强的铁、先等杂质,电解时铁、锌杂质先放电,且铁摩尔质量小于铜的64g/mol,锌的摩尔质量大于铜的摩尔质量,所以阳极减少6.4g,转移的电子的物质的量不一定为0.2mol,故C错误;
D、78gNa2O2的物质的量为1mol,而过氧化钠与二氧化碳的反应为歧化反应,1mol过氧化钠转移1mol电子,即NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.某小组设计如图装置研究电化学原理,下列说法中错误的是( )
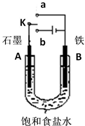

| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 | |
| C. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| D. | 若开始时开关K与b连接,则反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同) |
18. 最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )
最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )
 最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )
最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )| A. | 应用高效洁净的能源转换技术,在大型燃煤锅炉上安装低氮燃烧器,采用烟气脱硝技术 | |
| B. | 不放烟花焰火,加强道路扬尘污染控制,强化路面保洁,洒水防尘 | |
| C. | 在炼油厂.钢铁厂.发电厂等,推广和使用脱硫技术,降低硫氧化物的排放 | |
| D. | 研究采煤.采油新技术,增加汽油.柴油等能源的供应量,提倡以汽车代步的现代消费与生活理念 |
5.下列有关同分异构体数目的叙述错误的是( )
| A. | 分子式为C7H8O,且属于芳香族化合物的同分异构体只有4种 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物最多有6种 | |
| C. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| D. | 联苯(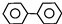 )的一氯代物有3种,二氯代物有12种 )的一氯代物有3种,二氯代物有12种 |
2.某分子式为C3H5Cl的有机物同分异构体的数目为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
19.某学习小组利用图1装置制取乙酸乙酯.
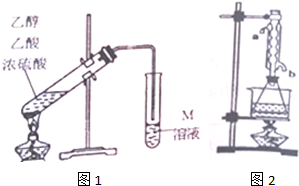
请回答下列问题:
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.

| 相对分子质量 | 沸点(℃) | |
| 乙醇 | 46 | 78.5 |
| 乙酸 | 60 | 117.9 |
| 乙酸乙酯 | 88 | 77.1 |
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.
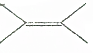 的二氯代物有4种.
的二氯代物有4种.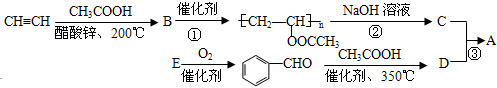
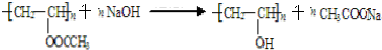 ;反应类型是取代反应.
;反应类型是取代反应. .
.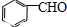 能发生银镜反应,该反应的化学方程式是
能发生银镜反应,该反应的化学方程式是 .
.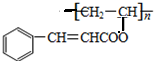 ,关于A的性质下列说法正确的是acd(填字母).
,关于A的性质下列说法正确的是acd(填字母).