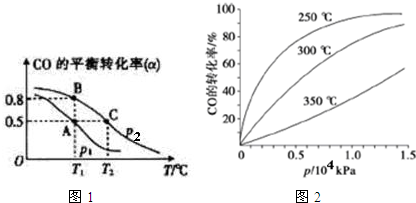
题目内容
17.下列说法正确的是( )| A. | 一氯代烷烃,随C原子数的增多,密度依次增大 | |
| B. | 常温下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 饱和一元羧酸,随C原子数的增多,酸性逐渐减弱 | |
| D. | 邻-二甲苯、间-二甲苯,对-二甲苯的沸点依次升高 |
分析 A.氯代烷烃中,其密度与相对分子质量成正比;
B.常温下,同分异构体中含有支链越多其烷烃熔沸点越低;
C.饱和一元羧酸中,烃基越大,其酸性越弱;
D.苯的同系物中,整个分子的对称性越好,其沸点越低.
解答 解:A.氯代烷烃中,其密度与相对分子质量成正比,所以一氯代烷烃,随C原子数的增多,密度依次增大,故A正确;
B.常温下,同分异构体中含有支链越多其烷烃熔沸点越低,所以正戊烷、异戊烷、新戊烷的沸点依次减小,故B错误;
C.饱和一元羧酸中,烃基越大,其酸性越弱,所以饱和一元羧酸,随C原子数的增多,酸性逐渐减弱,故C正确;
D.苯的同系物中,整个分子的对称性越好,其沸点越低,所以邻-二甲苯、间-二甲苯,对-二甲苯的沸点依次降低,故D错误;
故选AC.
点评 本题考查熔沸点、酸性强弱判断,侧重考查学生分析判断及规律总结能力,知道分子晶体熔沸点的影响因素是解本题关键,易错选项是C.

练习册系列答案
相关题目
8.一定温度下,向a L密闭容器中加入2mol NO2(g),发生反应:2NO2?2NO+O2,此反应达到平衡状态时的标志是( )
| A. | 混合气体的颜色变浅 | |
| B. | 混合气体的密度不再变化 | |
| C. | 混合气体中NO2、NO、O2物质的量之比为2:2:1 | |
| D. | 单位时间内生成2n mol NO,同时生成2n mol NO2 |
5.下列有关同分异构体数目的叙述错误的是( )
| A. | 分子式为C7H8O,且属于芳香族化合物的同分异构体只有4种 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物最多有6种 | |
| C. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| D. | 联苯( )的一氯代物有3种,二氯代物有12种 )的一氯代物有3种,二氯代物有12种 |
2.某分子式为C3H5Cl的有机物同分异构体的数目为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
9.化学与社会、生产、生活密切相关,下列说法正确的是( )
| A. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| B. | 研发易降解的生物农药有利于环境保护 | |
| C. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| D. | 常用无水酒精来消毒,是因为酒精能够使细菌蛋白发生变性 |
6.Ⅰ:图A为“人教版”教材制备乙酸乙酯的实验装置,某同学认为图B装置进行酯化反应效果比A要好,他的理由是便于冷凝回流,减少反应物损失.

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
(2)由上述实验可得出的结论是:同周期元素从左到右金属性逐渐减弱
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 镁浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | 有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | 剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | 反应不十分剧烈;产生无色气体 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 | 生成白色胶状沉淀,继而沉淀消失 |
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)
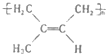 :其1mol单体跟1molBr2发生加成反应生成的产物有3种;
:其1mol单体跟1molBr2发生加成反应生成的产物有3种;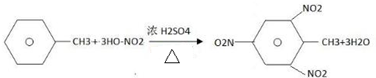 .
.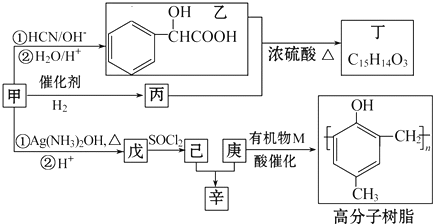

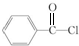 ,丁
,丁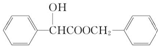 .
.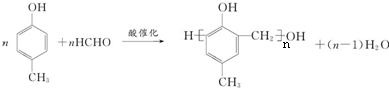 .
.