题目内容
11.下列反应属于氧化还原反应的是( )| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | ||
| C. | NH3+HCl═NH4Cl | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑ |
分析 氧化还原反应的特征是元素化合价的升降,可根据元素化合价的变化解答该题.
解答 解:A.H2SO4+2NaOH═Na2SO4+2H2O,为复分解反应,元素化合价没有发生变化,不属于氧化还原反应,故A错误;
B.CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O,Cu、H元素化合价发生变化,属于氧化还原反应,故B正确;
C.NH3+HCl═NH4Cl,元素化合价没有发生变化,不属于氧化还原反应,故C错误;
D.2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑,元素化合价没有发生变化,不属于氧化还原反应,故D错误.
故选B.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
2.某分子式为C3H5Cl的有机物同分异构体的数目为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
19.某学习小组利用图1装置制取乙酸乙酯.
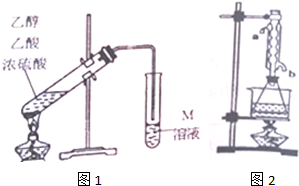
请回答下列问题:
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.

| 相对分子质量 | 沸点(℃) | |
| 乙醇 | 46 | 78.5 |
| 乙酸 | 60 | 117.9 |
| 乙酸乙酯 | 88 | 77.1 |
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.
6.Ⅰ:图A为“人教版”教材制备乙酸乙酯的实验装置,某同学认为图B装置进行酯化反应效果比A要好,他的理由是便于冷凝回流,减少反应物损失.

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
(2)由上述实验可得出的结论是:同周期元素从左到右金属性逐渐减弱
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 镁浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | 有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | 剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | 反应不十分剧烈;产生无色气体 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 | 生成白色胶状沉淀,继而沉淀消失 |
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)
16.下列有关化学反应速率与化学反应限度的叙述中,错误的是( )
| A. | 化学反应速率是表示化学反应快慢的物理量 | |
| B. | 一般情况下,升高温度能加快化学反应速率 | |
| C. | 可逆反应达到化学反应限度时,反应就静止不动了 | |
| D. | 可逆反应达到化学反应限度时,正反应速率等于逆反应速率 |
3.为了达到下表中的实验目的,请从“供选择的化学试剂及方法”栏中,选择正确的选项的字母代号填入对应的空格中.
| 序 号 | 实 验 目 的 | 答案 | 供选择的化学试剂及方法 |
| (1) | 实验室检验二氧化碳气体 | F | A让激光透过 B 滴入无色KSCN溶液 C抽少许纱,灼烧 D新制的Cu(OH)2,加热 E通过盛溴水的洗气瓶 F通入澄清石灰水中 |
| (2) | 鉴别溶液和胶体 | A | |
| (3) | 化验糖尿病 | D | |
| (4) | 鉴别Fe2+和Fe3+ | B | |
| (5) | 识别棉织品和毛织品 | C |
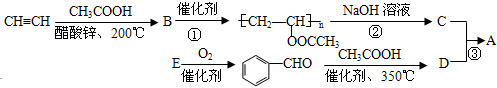
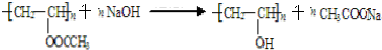 ;反应类型是取代反应.
;反应类型是取代反应. .
.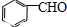 能发生银镜反应,该反应的化学方程式是
能发生银镜反应,该反应的化学方程式是 .
.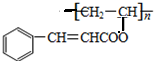 ,关于A的性质下列说法正确的是acd(填字母).
,关于A的性质下列说法正确的是acd(填字母).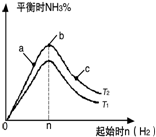 在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;