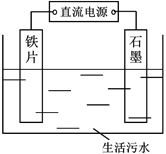
题目内容
【题目】某化学实验小组用如图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。

回答下列问题:
(1)开始实验之前要进行的操作是__。
(2)写出利用装置I制取氨气的化学方程式__。
(3)按照a、f、e、b、c、d的顺序将仪器连接,装置Ⅲ中倒置漏斗的作用是__,装置IV中仪器的名称为__,盛装的试剂为__。
【答案】检验装置气密性 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 防止倒吸 球形干燥管 碱石灰
CaCl2+2H2O+2NH3↑ 防止倒吸 球形干燥管 碱石灰
【解析】
由实验目的可知,装置I用于制取氨气,装置IV中盛有的碱石灰,目的是用于干燥氨气,装置Ⅱ是用向下排空气法收集氨气,装置Ⅲ中倒置漏斗的作用是防止氨气溶于水产生倒吸,则装置的连接顺序为I、IV、Ⅱ、Ⅲ,仪器接口的连接顺序为a、f、e、b、c、d。
(1)与气体有关的实验,实验前进行的操作是检验装置气密性,本实验的目的是装置制取、收集纯净干燥的氨气,则实验前要进行的操作是检验装置气密性,故答案为:检验装置气密性;
(2)装置I中氯化铵固体与氢氧化钙固体共热反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(3)由于氨气极易溶于水,装置Ⅲ中倒置漏斗的作用是防止氨气溶于水产生倒吸;装置IV中仪器的名称为球形干燥管,其中盛有的碱石灰用于干燥氨气,故答案为:防止倒吸;球形干燥管;碱石灰。

【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___。
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃C)比MnS的熔点(1610℃)高,其主要原因是_________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
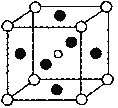
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置。
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为______。