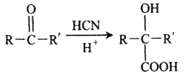
题目内容
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
【答案】B
【解析】
A.因为F的非金属性较强,对应的氢化物HF分子间可形成氢键,沸点较高,故A错误;
B. CH4中只含有C-H极性键,CCl4中只含有C-Cl极性键,CH4、CCl4的空间构型为正四面体,分子结构对称,正负电荷中心重合的属于非极性分子,故B正确;
C. H2S分子中,S原子形成2个![]() 键,孤电子对数为
键,孤电子对数为![]() =2,则为sp3杂化,为V形,CS2、C2H2中心原子的杂化方式sp杂化,为直线形分子,故C错误;
=2,则为sp3杂化,为V形,CS2、C2H2中心原子的杂化方式sp杂化,为直线形分子,故C错误;
D.Cl元素的化合价越高,对应的氧化物的水化物的酸性越强,则酸性HClO4>HClO3>HClO2 >HClO,故D错误。
所以B选项是正确的。

练习册系列答案
相关题目