题目内容
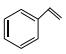
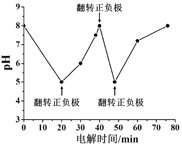
【题目】某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为![]() ],酸液室通入
],酸液室通入![]() (以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
A. 电子由N极经外电路流向M极
B. N电极区的电极反应式为![]() ↑
↑
C. 在碱液室可以生成 ![]()
D. 放电一段时间后,酸液室溶液pH减小
【答案】B
【解析】
氢气在电极M表面失电子转化为氢离子,为电池的负极,碱液室中的氢氧根离子透过阴离子交换膜,中和正电荷。酸液室中的氢离子透过质子交换膜,在电极N表面得到电子生成氢气,电极N为电池的正极,同时,酸液室中的氯离子透过阴离子交换膜进入碱液室,补充负电荷,据此答题。
A.电极M为电池的负极,电子由M极经外电路流向N极,故A错误;
B.酸液室中的氢离子透过质子交换膜,在电极N表面得到电子生成氢气,N电极区的电极反应式为2H++2e-=H2↑,故B正确;
C.酸液室与碱液室之间为阴离子交换膜,钠离子不能进入碱液室,应在酸液室得到NaHCO3、Na2CO3,故C错误;
D.放电一段时间后,酸液室氢离子被消耗,最终得到NaHCO3、Na2CO3,溶液pH增大,故D错误。
故选B。

【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___。
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃C)比MnS的熔点(1610℃)高,其主要原因是_________。
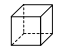
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
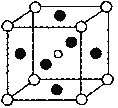
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置。
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为______。
【题目】根据下表所示化学反应与数据关系:
化学反应 | 平衡常数 | 温度 | |
973 K | 1 173 K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
请回答:
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有________(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
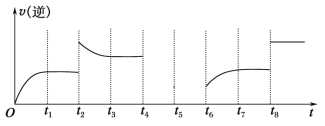
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性![]() 溶液氧化为MnO4-,该方法可用于检验Mn2+。
溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ ![]() 可看成两分子硫酸偶合所得,若硫酸的结构式为
可看成两分子硫酸偶合所得,若硫酸的结构式为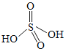 ,则
,则![]() 的结构式为_________。
的结构式为_________。
(2)实验室用含锰废料(主要成分![]() ,含有少量
,含有少量![]() )制备Mn的流程如下:
)制备Mn的流程如下:
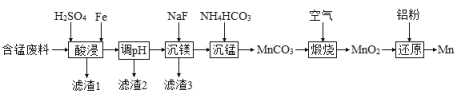
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
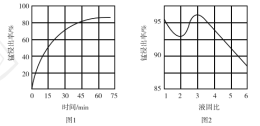
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。