题目内容
5.我国盛产软锰矿和闪锌矿,某化工厂以软锰矿、闪锌矿(主要成分为MnO2、ZnS,还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2,其流程如下: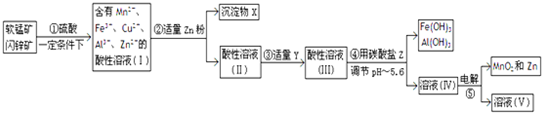
回答下列问题:
(1)操作①中发生多种反应,其中MnO2和FeS在硫酸下生成单质S的化学反应方程式为:3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S+6H2O.
(2)操作②中分离产物的方法为过滤,沉淀物X中除了单质S外,还有Cu(填化学式).操作②中发生反应的离子方程式有:Zn+Cu2+=Zn2++Cu、Zn+2Fe3+=Zn2++2Fe2+.
(3)操作③中物质Y最适宜的是C.
A.Fe B.Al C.MnO2 D.K2Cr2O7
(4)操作④中碳酸盐可选C、D.
A.CaCO3 B.Na2CO3 C.MnCO3 D.ZnCO3
(5)操作⑤中电解时阴极发生的反应为:Zn2++2e-=Zn.
分析 软锰矿、闪锌矿(主要成分为MnO2、ZnS,还含有少量的FeS、CuS、Al2O3等物质)溶于硫酸得含有Mn 2+、Fe3+、Zn2+、Fe2+、Cu2+的酸性溶液,向其中加入适量的锌粉,将铜离子置换出来得沉淀X含有铜,同时将铁离子还原为亚铁离子,再向溶液中加入氧化剂将亚铁离子氧化成铁离子,加氧化剂的同时不能引入新的杂质,所以可以用二氧化锰作氧化剂,步骤④中用碳酸盐调节溶液的pH值,使铁离子和铝离子沉淀,过滤得滤液中含有Mn 2+、Zn2+,电解滤液得锌和二氧化锰,据此答题.
解答 解:软锰矿、闪锌矿(主要成分为MnO2、ZnS,还含有少量的FeS、CuS、Al2O3等物质)溶于硫酸得含有Mn 2+、Fe3+、Zn2+、Fe2+、Cu2+的酸性溶液,向其中加入适量的锌粉,将铜离子置换出来得沉淀X含有铜,同时将铁离子还原为亚铁离子,再向溶液中加入氧化剂将亚铁离子氧化成铁离子,加氧化剂的同时不能引入新的杂质,所以可以用二氧化锰作氧化剂,步骤④中用碳酸盐调节溶液的pH值,使铁离子和铝离子沉淀,过滤得滤液中含有Mn 2+、Zn2+,电解滤液得锌和二氧化锰,
(1)操作①中发生多种反应,其中MnO2和FeS在硫酸下发生氧化还原反应生成单质S、硫酸锰、硫酸铁,反应的化学反应方程式为3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S+6H2O,
故答案为:3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S+6H2O;
(2)操作②是分离固体和溶液,可以用过滤的方法,根据上面的分析可知沉淀物X中除了单质S外,还 Cu,操作②中发生反应的离子方程式为Zn+Cu2+=Zn2++Cu、Zn+2Fe3+=Zn2++2Fe2+,
故答案为:过滤;Cu;Zn+Cu2+=Zn2++Cu、Zn+2Fe3+=Zn2++2Fe2+;
(3)根据上面的分析可知,操作③中物质Y最适宜的是MnO2,故选C;
(4)由于溶液中含有锌离子和锰离子,所以调节pH值时可用MnCO3、ZnCO3,这样不引入新的杂质,故选C、D;
(5)电解含有Mn 2+、Zn2+的溶液时,阴极上锌离子发生还原反应生成锌单质,反应的电极反应为Zn2++2e-=Zn,故答案为:Zn2++2e-=Zn.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案| A. | 中性溶液Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | $\frac{{K}_{W}}{c{(H}^{+})}$=10-13mol•L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3- | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、H+、ClO-、SO42- |
①天然气 ②煤 ③核能 ④水电 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能.
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③④⑨⑥ | D. | 除①②外 |
| A. | 1处 | B. | 2处 | C. | 3处 | D. | 4处 |
| A. | 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 在2s时体系内压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含有N2O40.25 mol | |
| D. | 平衡时,N2O4的转化率为40% |
 苯与液溴制取溴苯
苯与液溴制取溴苯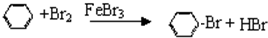 反应类型:取代反应
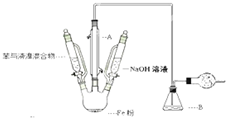
反应类型:取代反应 二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置. ,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.
,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.