题目内容
7.如图是某学生设计的加热碳酸氢钠的实验装置图,其中错误的地方共有( )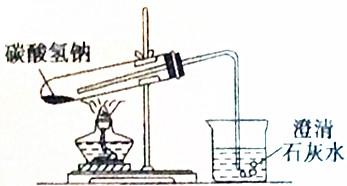
| A. | 1处 | B. | 2处 | C. | 3处 | D. | 4处 |
分析 碳酸氢钠加热分解生成水,试管中粉末易堵塞导管,加热时对着药品先预热后集中加热,以此来解答.
解答 解:由图可知,加热时没有对药品加热,且先预热后集中加热;
试管口没有略向下倾斜,易导致水倒流,试管炸裂;
伸入试管的导管太长,气体不易排出,应刚露出橡皮塞,
共3处错误,
故选C.
点评 本题考查实验装置的综合应用,为高频考点,把握碳酸氢钠的性质及实验细节为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
17.NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 1molN2与过量H2反应,转移6NA个电子 | |
| C. | 1L1.0mo1/L的Na2SO4水溶液中含有的氧原子数为4NA | |
| D. | 1L0.1mol/L的氨水中有NA个NH4+ |
3.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+;=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+;=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
 碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题:
碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题: