题目内容
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为 ,其分子属于 (填“极性”、“非极性”)分子.D与C形成的化合物D2C2可与Y反应生成单质C,该反应的化学方程式为 .
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出工业生产单质E的化学反应方程式: .
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8g W气体(已知n(A):n(B)=3:1,可放出18.44kJ热量,则该反应的热化学方程式为 ,W的空间构型为 .
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为 .
(5)在10L的密闭容器中,通入2mol的FC2气体和3mol C的气体单质,一定条件下反应后生成FC2气体,当反应达到平衡时,单质C的浓度为0.21mol?L-1,则平衡时FC2的转化率为 .
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出工业生产单质E的化学反应方程式:
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8g W气体(已知n(A):n(B)=3:1,可放出18.44kJ热量,则该反应的热化学方程式为
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为
(5)在10L的密闭容器中,通入2mol的FC2气体和3mol C的气体单质,一定条件下反应后生成FC2气体,当反应达到平衡时,单质C的浓度为0.21mol?L-1,则平衡时FC2的转化率为
分析:A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;C元素的原子最外层电子数是次外层电子数的三倍,C原子有2个电子层,最外层电子数为6,故C为氧元素;C与F为同一主族,则F为硫元素;A与D为同一主族,且D的原子序数大于氧元素,D是所在周期原子半径最大的元素,故D为Na元素;六种元素所形成的常见单质在常温压下有三种是气体,三种是固体,故B、E的单质一种为气体、一种为固体,E的原子序数大于钠元素小于硫元素,故E为固体、B为气体,B的原子序数小于氧元素,则B为氮元素;由(2)可知,E是非金属元素,其单质在电子工业中有重要应用,则E为Si元素,据此解答.
解答:解:A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;C元素的原子最外层电子数是次外层电子数的三倍,C原子有2个电子层,最外层电子数为6,故C为氧元素;C与F为同一主族,则F为硫元素;A与D为同一主族,且D的原子序数大于氧元素,D是所在周期原子半径最大的元素,故D为Na元素;六种元素所形成的常见单质在常温压下有三种是气体,三种是固体,故B、E的单质一种为气体、一种为固体,E的原子序数大于钠元素小于硫元素,故E为固体、B为气体,B的原子序数小于氧元素,则B为氮元素;由(2)可知,E是非金属元素,其单质在电子工业中有重要应用,则E为Si元素,
(1)由H、O两种元素组成的成X、Y两种化合物,X在一定条件下可以分解成Y,则X为H2O2、Y为H2O,H2O2中氧原子最高价形成1对共用电子对、氧原子与氢原子之间形成1对共用电子对,故H2O2的电子式为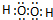 ,氧原子构成V型结构,为展开书页型结构,正负电荷重心不重合,其分子属于极性分子,
,氧原子构成V型结构,为展开书页型结构,正负电荷重心不重合,其分子属于极性分子,
D与C形成的化合物为Na2O2,与H2O反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,
故答案为: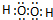 ;极性;2Na2O2+2H2O═4NaOH+O2↑;
;极性;2Na2O2+2H2O═4NaOH+O2↑;
(2)工业上,由碳在高温下与二氧化硅反应制备Si,反应方程式为:2C+SiO2
Si+2CO↑,
故答案为:2C+SiO2
Si+2CO↑;
(3)一定条件下,氢气与氮气充分反应生成6.8g氨气,放出18.44kJ热量,氨气的物质的量为
=0.4mol,故生成2mol氨气放出的热量为
×18.44kJ=92.2kJ,故该反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g),△H=-92.2kJ/mol,NH3属于三角锥型;
故答案为:N2(g)+3H2(g)═2NH3(g),△H=-92.2kJ/mol;三角锥型;
(4)氢气与氧气在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,氢气在M极放电,发生氧化反应,碱性条件下生成水,故M极的电极反应式为:H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O;
(5)在10L的密闭容器中,通入2mol SO2气体和3mol O2气体,一定条件下反应后生成SO3气体,发生反应2SO2+O2?2SO3,当反应达到平衡时,O2的浓度为0.21mol/L,参加反应的氧气为3mol-0.21mol/L×10L=0.9mol,根据方程式可知,平衡时参加反应SO2的物质的量为0.9mol×2=1.8mol,故二氧化硫的转化率为
×100%=90%,
故答案为:90%.
(1)由H、O两种元素组成的成X、Y两种化合物,X在一定条件下可以分解成Y,则X为H2O2、Y为H2O,H2O2中氧原子最高价形成1对共用电子对、氧原子与氢原子之间形成1对共用电子对,故H2O2的电子式为
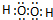 ,氧原子构成V型结构,为展开书页型结构,正负电荷重心不重合,其分子属于极性分子,
,氧原子构成V型结构,为展开书页型结构,正负电荷重心不重合,其分子属于极性分子,D与C形成的化合物为Na2O2,与H2O反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:
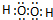 ;极性;2Na2O2+2H2O═4NaOH+O2↑;
;极性;2Na2O2+2H2O═4NaOH+O2↑;(2)工业上,由碳在高温下与二氧化硅反应制备Si,反应方程式为:2C+SiO2
| ||
故答案为:2C+SiO2
| ||
(3)一定条件下,氢气与氮气充分反应生成6.8g氨气,放出18.44kJ热量,氨气的物质的量为
| 6.8g |
| 17g/mol |
| 2mol |
| 0.4mol |
故答案为:N2(g)+3H2(g)═2NH3(g),△H=-92.2kJ/mol;三角锥型;
(4)氢气与氧气在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,氢气在M极放电,发生氧化反应,碱性条件下生成水,故M极的电极反应式为:H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O;
(5)在10L的密闭容器中,通入2mol SO2气体和3mol O2气体,一定条件下反应后生成SO3气体,发生反应2SO2+O2?2SO3,当反应达到平衡时,O2的浓度为0.21mol/L,参加反应的氧气为3mol-0.21mol/L×10L=0.9mol,根据方程式可知,平衡时参加反应SO2的物质的量为0.9mol×2=1.8mol,故二氧化硫的转化率为
| 1.8mol |
| 2mol |
故答案为:90%.
点评:本题考查结构性质位置关系、电子式、热化学方程式书写、原电池、化学平衡有关计算等,题目较为综合,难度不大,旨在考查学生对基础知识的理解掌握,推断元素是解题关键.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.