题目内容
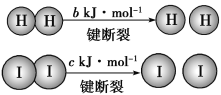
【题目】在固态金属氧化物电解池中,高温电解H2OCO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A.X是电源的负极
B.阴、阳两极生成的气体的物质的量之比是1∶1
C.总反应可表示为H2O+CO2![]() H2+CO+O2
H2+CO+O2
D.阴极的电极反应式是H2O+2e-=H2+O2-、CO2+2e-=CO+O2-
【答案】B
【解析】
高温共电解H2O-CO2混合气体制备H2和CO,可以看作是电解H2O气体制备H2、O2(2H2O![]() 2H2↑+O2↑)和电解CO2气体制备CO、O2(2CO2
2H2↑+O2↑)和电解CO2气体制备CO、O2(2CO2![]() 2CO+O2),电极反应分别为:阳极(失电子,发生氧化反应):2H2O-4eˉ=O2+4H+ ; CO2-4eˉ=O2+C4+ 。
2CO+O2),电极反应分别为:阳极(失电子,发生氧化反应):2H2O-4eˉ=O2+4H+ ; CO2-4eˉ=O2+C4+ 。
阴极(得电子,发生还原反应):2H2O+4eˉ=2H2+O2ˉ ; 2CO2+2eˉ=2CO+2O2ˉ。
所以,总反应可表示为:H2O+CO2![]() H2+CO+O2 ;阴、阳两极生成的气体的物质的量之比是2︰1。依据电解池原理,阴极与电源的负极相连,据图中所示,与X相连的电极上发生H2O→H2,CO2→CO的转化,均为得电子,发生还原反应,故与X相连的电极为电解池的阴极,则X是电源的负极。
H2+CO+O2 ;阴、阳两极生成的气体的物质的量之比是2︰1。依据电解池原理,阴极与电源的负极相连,据图中所示,与X相连的电极上发生H2O→H2,CO2→CO的转化,均为得电子,发生还原反应,故与X相连的电极为电解池的阴极,则X是电源的负极。
综上分析可知,选项B不正确。
答案选B。

练习册系列答案
相关题目