题目内容
【题目】(1)将9.5gMgCl2溶于水配成1L溶液,所得溶液的物质的量浓度为___mol/L,500mL该溶液中所含Cl-的物质的量为___mol。
(2)含有2NA个氢原子的CH4的质量为___g。
(3)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用下列序号填空:能导电的是___(填选项);属于电解质的是___(填选项)。
A.①③ B.②④ C.①④ D.②③
【答案】0.1 0.1 8 A C
【解析】
(1)先根据![]() 计算MgCl2的物质的量,再根据c=
计算MgCl2的物质的量,再根据c=![]() 计算出所得溶液的浓度;
计算出所得溶液的浓度;
(2)先根据关系式![]() 计算CH4的物质的量,再根据m=nM计算甲烷的质量;
计算CH4的物质的量,再根据m=nM计算甲烷的质量;
(3)含有自由移动离子的物质能导电;水溶液或熔融状态下能导电和化合物是电解质。
(1) 9.5gMgCl2的物质的量是![]() , c=
, c=![]() =
=![]() 0.1 mol/L;500mL该溶液中所含MgCl2的物质的量为0.1 mol/L×0.5L=0.05mol,则含Cl-的物质的量为0.05mol ×2=0.1mol;
0.1 mol/L;500mL该溶液中所含MgCl2的物质的量为0.1 mol/L×0.5L=0.05mol,则含Cl-的物质的量为0.05mol ×2=0.1mol;
(2)2NA个氢原子的物质的量是2mol,根据关系式![]() 可知,0.5mol CH4含有2molH原子,所以CH4的质量是0.5mol×16g/mol=8g。
可知,0.5mol CH4含有2molH原子,所以CH4的质量是0.5mol×16g/mol=8g。
(3)①熔融NaCl含有自由移动的离子,能导电,属于电解质; ②液氨不含自由移动的离子,不导电,熔融状态下、水溶液中均不能自身电离出离子,所以属于非电解质; ③醋酸水溶液 含有自由移动的离子,能导电,醋酸水溶液是混合物,既不是电解质又不是非电解质;④HCl气体不含自由移动的离子,不导电,HCl的水溶液能导电,所以HCl属于电解质; ⑤酒精(C2H5OH)不含自由移动的离子,不导电,熔融状态下、水溶液中均不能自身电离出离子,所以属于非电解质;故能导电的是①③,选A;属于电解质的是.①④,选C。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=393.5kJ·mol1
2C(s)+O2(g)=2CO(g) △H2=221.0kJ·mol1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式___。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
下列能说明该反应已经达到平衡状态的是___(填字母代号)。
A.![]() 比值不变
比值不变
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。
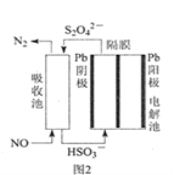
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式___。用离子方程式表示吸收池中除去NO的原理___。
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g)![]() 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 2 | 1.2 | 0.8 | 0.4 | 0.4 | 0.4 |
n(O2)/mol | 1.2 | 0.8 | 0.6 | 0.4 | 0.4 | 0.4 |
①T1温度时![]() =___L/mol。
=___L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=")。
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
(5)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与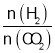 的关系如图所示:
的关系如图所示:
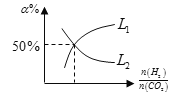
①图中CO2的平衡转化率可用表示___(L1或L2)
②该温度下,反应X的平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。