题目内容
【题目】氢气是热量高、无污染的燃料,天然气储量丰富是理想的制氢原料,研究甲烷制氢具有重要的理论和现实意义。
(1)甲烷水蒸气重整制氢:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H1=+216kJmol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
CO(g)+3H2(g)△H1=+216kJmol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
(2)①将甲烷水蒸气重整和甲烷氧化重整两种方法结合,理论上按照空气、甲烷、水蒸气约15:7:1体积比进料(空气中氧气体积分数约为0.2),可以实现反应器中能量自给(不需要补充热量)。
甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=____kJmol-1
②实际生产中,空气、甲烷、水蒸气按照约1:1:2体积比进料,增加水蒸气的作用是____,还能发生____(用化学方程式表示)反应,从而获得更多的氢气。
(3)甲烷水蒸气重整过程中,温度1000K,原料气以57.6Kgh-1通入容积为1L镍基催化反应器中,2-5s甲烷质量分数由7.32%变为5.32%,用甲烷表示2-5s的反应速率为____molmin-1 ,随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定,造成____。有人提出将甲烷水蒸气重整和甲烷氧化重整两种方法结合则能解决这个问题,原因是____。
【答案】50% 2.16×10-3 1:1 -72 促进反应正向移动,提高甲烷的转化率 CO+H2O![]() CO2+H2 1.2 催化剂积碳 氧气会与积碳反应,从而消碳
CO2+H2 1.2 催化剂积碳 氧气会与积碳反应,从而消碳
【解析】
(1)依据化学方程式和题中所给的数据,计算出平衡时CH4、H2O、CO、H2的物质的量,计算出它们的物质的量分数以及出它们的分压,计算Kp;
(2)根据题中信息,甲烷水蒸气重整制氢:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H1=+216kJmol-1,甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2,实现反应器中能量自给(不需要补充热量),即按一定的比例甲烷水蒸气重整制氢吸收的热量与甲烷氧化重整制氢放出的热量相等,进行相关计算;
CO(g)+3H2(g)△H1=+216kJmol-1,甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2,实现反应器中能量自给(不需要补充热量),即按一定的比例甲烷水蒸气重整制氢吸收的热量与甲烷氧化重整制氢放出的热量相等,进行相关计算;
(3)依据反应速率的定义,单位时间内甲烷浓度的变化量,计算出甲烷的反应速率,在计算的时候,注意单位之间的换算。
(1)根据题意,假设n(CH4)=xmol,n(H2O)=3x mol,甲烷转化率为![]() ,则
,则
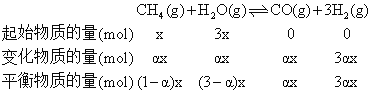
平衡时气体的总物质的量为(1-![]() )xmol+(3-
)xmol+(3-![]() )xmol+
)xmol+![]() xmol+3
xmol+3![]() xmol=(4+2
xmol=(4+2![]() )xmol,因为达到平衡时氢气的物质的量分数为0.3,即
)xmol,因为达到平衡时氢气的物质的量分数为0.3,即 ![]() ,
,![]() =0.5,所以平衡后的总物质的量为5x mol,平衡后n(CH4)=0.5xmol、n(H2O)=2.5xmol、n(CO)=0.5xmol、n(H2)=1.5x mol,平衡后CH4的分压为
=0.5,所以平衡后的总物质的量为5x mol,平衡后n(CH4)=0.5xmol、n(H2O)=2.5xmol、n(CO)=0.5xmol、n(H2)=1.5x mol,平衡后CH4的分压为![]() ,同一容器中 CH4、H2O、CO、H2分压之比等于物质的量之比,即p(CH4):p(H2O):p(CO):p(H2)= 0.5xmol:2.5xmol:0.5xmol:1.5x mol =1:5:1:3,所以p(H2O)=0.1Mpa、p(CO)=0.02Mpa,p(H2)=0.06Mpa,
,同一容器中 CH4、H2O、CO、H2分压之比等于物质的量之比,即p(CH4):p(H2O):p(CO):p(H2)= 0.5xmol:2.5xmol:0.5xmol:1.5x mol =1:5:1:3,所以p(H2O)=0.1Mpa、p(CO)=0.02Mpa,p(H2)=0.06Mpa,
![]() ;理论上水碳起始物质的量之比等于化学方程式中的化学计量数之比时,即水碳起始物质的量之比1:1,氢气的物质的量分数将达到最大;
;理论上水碳起始物质的量之比等于化学方程式中的化学计量数之比时,即水碳起始物质的量之比1:1,氢气的物质的量分数将达到最大;
(2)①将甲烷水蒸汽重整和甲烷氧化重整两种方法结合,理论上按照空气、甲烷、水蒸汽约15:7:1体积比进料(空气中氧气体积分数约为0.2),则氧气、甲烷、水蒸汽约3:7:1体积比进料,令参加反应消耗氧气、甲烷、水蒸气的物质的量分别为3mol、7mol、1mol,
甲烷水蒸气重整制氢:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H1=+216kJmol-1,甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2,令△H2=-y kJmol-1,结合方程式以及反应可以实现反应器中能量自给(不需要补充热量),故有1mol CH4、1mol H2O(g)参加甲烷水蒸气重整制氢吸收的热量为216kJ;6mol CH4、3mol O2参加氧化重整制氢,故3y=216,y=72,所以甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=-72kJmol-1;
CO(g)+3H2(g)△H1=+216kJmol-1,甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2,令△H2=-y kJmol-1,结合方程式以及反应可以实现反应器中能量自给(不需要补充热量),故有1mol CH4、1mol H2O(g)参加甲烷水蒸气重整制氢吸收的热量为216kJ;6mol CH4、3mol O2参加氧化重整制氢,故3y=216,y=72,所以甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=-72kJmol-1;
②实际生产中,空气、甲烷、水蒸汽按照约1:1:2体积比进料,增加水蒸气的作用是提高甲烷的转化率,另外甲烷水蒸气重整制氢、甲烷氧化重整制氢生成的CO能与水蒸气反应生成H2,其反应方程式为CO+H2O ![]() CO2+H2;
CO2+H2;
(3)甲烷水蒸汽重整过程中,温度1000K,原料气以57.6Kgh-1通入容积为1L镍基催化反应器中,![]() ,2-5s甲烷质量分数由7.32%变为5.32%,所以2-5s甲烷质量减少量为16×(7.32%-5.32%)
,2-5s甲烷质量分数由7.32%变为5.32%,所以2-5s甲烷质量减少量为16×(7.32%-5.32%)![]() 3=0.96g,2-5s甲烷变化的物质的量为
3=0.96g,2-5s甲烷变化的物质的量为
![]() ,
,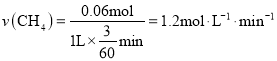 ;随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定, CH4
;随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定, CH4![]() C+2H2,生成的碳覆盖在催化剂表面,使催化剂中毒;氧气会消耗催化剂表面的积碳,故将甲烷水蒸汽重整和甲烷氧化重整两种方法结合能处理催化剂表面的积碳。
C+2H2,生成的碳覆盖在催化剂表面,使催化剂中毒;氧气会消耗催化剂表面的积碳,故将甲烷水蒸汽重整和甲烷氧化重整两种方法结合能处理催化剂表面的积碳。

 阅读快车系列答案
阅读快车系列答案【题目】硅在无机非金属材料中,扮演着主要角色,请利用相关知识回答下列问题:
(1)硅有非常重要的用途,请写出其中的一种:_________________________________。
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是________。
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:
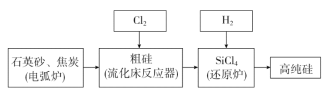
①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式:________________。
②SiCl4极易水解,在空气中生成烟尘和白雾,推测书写其水解的化学方程式为____________________。
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D