题目内容
【题目】氨和甲烷等原料在工业生产中发挥着重要的作用。
Ⅰ.我国科学家以MoS2 为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图所示。
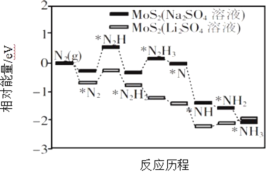
(1)将Na2SO4 溶液换成Li2SO4 溶液后,反应速率明显加快的主要原因是加快了下列____________转化的反应速率(填标号)。
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
Ⅱ. 甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(2)已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH1=akJ·mol—1,
2CO(g)+O2(g)= 2CO2(g) ΔH2=b kJ·mol—1,
2H2(g) +O2(g)=2 H2O (l) ΔH3=c kJ·mol—1
CO(g)+ H2O(g)= CO2(g)+ H2 (g) ΔH4=d kJ·mol—1
则甲烷水蒸气重整反应的ΔH=____________kJ·mol—1(用字母a、b、c、d表示)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2物质的量分数与水碳比、平衡温度的关系如图所示:
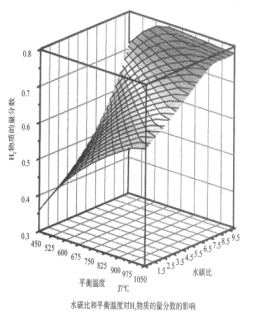
①结合如图回答:当平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系是________,其原因是_____________。
②若密闭容器中仅发生CH4(g)+H2O(g)![]() CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
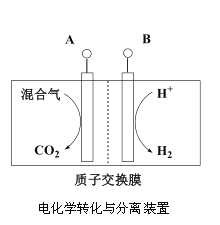
Ⅲ.利用天然气合成氨,并生产尿素的流程如下:
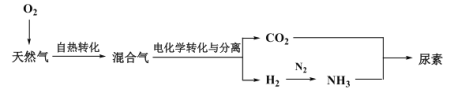
(3)“电化学转化与分离”装置如图,混合气中CO转化成CO2的电极反应式为______。
【答案】B (a+d-b-c) 水碳水比大时,H2的物质的量分数越大 水碳水比较大时,CO会与H2O进一步反应生成H2,使H2的物质的量分数增大 50.0% 7.5×10-3(MPa) ![]() CO-2e-+H2O=CO2+2H+
CO-2e-+H2O=CO2+2H+
【解析】
(1)由图可知,![]() 需要吸收的能量最高,是该反应过程中的决定反应速率的步骤,将Na2SO4 溶液换成Li2SO4 溶液后,
需要吸收的能量最高,是该反应过程中的决定反应速率的步骤,将Na2SO4 溶液换成Li2SO4 溶液后,![]() 需要的能量降低,反应速率加快,故选B;
需要的能量降低,反应速率加快,故选B;
(2)设CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH1=akJ·mol—1,为反应①;
2CO(g)+O2(g)= 2CO2(g) ΔH2=b kJ·mol—1,为反应②;
2H2(g) +O2(g)=2 H2O (l) ΔH3=c kJ·mol—1,为反应③;
CO(g)+ H2O(g)= CO2(g)+ H2 (g) ΔH4=d kJ·mol—1为反应④;
根据盖斯定律,反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)可由①+④-②-③得到,故该反应的ΔH= (a+d-b-c) kJ·mol—1;
CO(g)+3H2(g)可由①+④-②-③得到,故该反应的ΔH= (a+d-b-c) kJ·mol—1;
①根据曲线走势可知,水碳比越大,H2的物质的量分数越大;根据题(2)中的反应可知,当水碳比较大时,甲烷水解重整反应体系中会存在CO与H2O的反应CO(g)+ H2O(g)= CO2(g)+ H2 (g),会使H2的物质的量分数增大;
②由于水碳比为1.0,设开始加入的CH4和H2O的物质的量都为![]() ,转化的物质的量为
,转化的物质的量为![]() 。
。
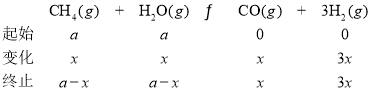
![]() ,解得
,解得![]() =0.5
=0.5![]() mol,故CH4的转化率为
mol,故CH4的转化率为![]() ;
;
反应后的总物质的量为3![]() mol,所以CH4、H2O、CO、H2的分压分别为:
mol,所以CH4、H2O、CO、H2的分压分别为:![]() 、
、![]() 、
、![]() 、
、![]() ,
, ;
;
用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2)=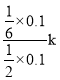 =
= ![]() ;
;
(3)CO转化成CO2时CO失电子,电极反应为:CO-2e-+H2O=CO2+2H+。

【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D