题目内容
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol—1
下列说法不正确的是:
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1 |
| B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同 |
| C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol |
B
解析试题分析:A、①反应中水的状态是气态,而CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q中,水是液态,从气态到液态要放出热量,所以Q>574kJ·mol—1,正确;B、甲烷对应的氧化产物都是CO2,所以等物质的量的甲烷分别参加反应①、②,反应转移的电子数相同,错误;C、将两个方程式相加得CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol—1,所以用标准状况下4.48L CH4还原NO2至N2,放出的热量为4.48L/22.4L/mol×867kJ·mol—1=173.4kJ,正确;D、标准状况下4.48L CH4的物质的量为0.2mol,所以转移电子的物质的量为0.2mol×8=1.6mol,正确,答案选B。
考点:考查盖斯定律的应用及氧化还原反应

NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋
白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力。
(1)美蓝是亚硝酸盐中毒的有效解毒剂,下列说法正确的是 。(选填编号)
| A.解毒时美蓝表现氧化性 | B.中毒时亚硝酸盐发生氧化反应 |
| C.解毒时高铁血红蛋白被还原 | D.中毒过程中血红蛋白显氧化性 |
(3)Na、N、O分别与H形成的简单化合物中熔点最高的是 (填化合物化学式),试解释原因 。
(4)已知NaNO2能发生如下反应(未配平):NaNO2 + HI → NO + I2 + NaI + H2O当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)有人将26中反应产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107 Pa,然后加热至50℃时,发现气体的压力迅速下降。当温度恢复到常温,压强降至略小于1.01×107 Pa的2/3时,就不再改变。已知此过程中有一种产物是N2O。请写出生成N2O的反应方程式: 。
解释最后的气体压强略小于1.01×107 Pa的2/3原因: 。
(6)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染,下列试剂中①NaCl、②
NH4Cl、③HNO3、④浓H2SO4,能使NaNO2转化为N2的是 。(选填编号)
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。则列判断正确的是
| A.反应中KNO3为还原剂 |
| B.NaN3中氮元素为-3价 |
| C.标准状况下,若有6.5gNaN3参加反应,则生成3.584L N2 |
| D.若1mol KNO,参加反应,转移电子的物质的量为10mol |
某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中c(NH4+)随反应进行逐渐减小。下列判断错误的是
| A.反应的氧化剂是ClO- |
| B.消耗l mol还原剂,转移电子3 mol |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O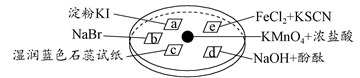
对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
下图是利用钛白粉生产海绵钛(Ti)的一种工艺流程:
有关说法正确的是( )
| A.反应Ⅰ中钛白粉(TiO2)做氧化剂 |
| B.该工艺中可以循环使用的物质只有Cl2 |
| C.可以用N2代替Ar作为反应Ⅱ中的保护气 |
D.反应Ⅱ的化学方程式为2Mg+TiCl4 2MgCl2+Ti 2MgCl2+Ti |
在Cu2S+2Cu2O 6Cu+SO2↑反应中,说法正确的是( )
6Cu+SO2↑反应中,说法正确的是( )
| A.Cu2O在反应中被氧化 |
| B.Cu2S在反应中既是氧化剂又是还原剂 |
| C.Cu既是氧化产物又是还原产物 |
| D.若反应中转移12 mol电子,则生成6 mol Cu |
ClO2是一种杀菌消毒效率高的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是( )
| A.ClO2是还原产物 |
| B.1 mol KClO3参加反应,失去电子为1 mol |
| C.H2C2O4在反应中被氧化 |
| D.H2C2O4的还原性大于ClO2的还原性 |
下列各组物质中只具有还原性的是 ( )。
| A.F-、CO、Na | B.Na、I-、Zn |
| C.Fe3+、SO42-、NO3- | D.Fe3+、O2、H2O2 |