题目内容
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。则列判断正确的是
| A.反应中KNO3为还原剂 |
| B.NaN3中氮元素为-3价 |
| C.标准状况下,若有6.5gNaN3参加反应,则生成3.584L N2 |
| D.若1mol KNO,参加反应,转移电子的物质的量为10mol |
C
解析试题分析:A、根据方程式可知硝酸钾中氮元素的化合价从+5价降低到0价得到电子,因此硝酸钾是氧化剂,A不正确;B、钠在化合物中显+1价,因此氮化钠中氮元素的化合价是-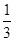 价,B不正确;C、6.5g氮化钠的物质的量是6.5g÷65g/mool=0.1mol,根据方程式可知反应中生成氮气的物质的量是0.16mol,则标准状况下氮气的体积是0.16mol×22.4L/mol=3.584L,C正确;D、硝酸钾中氮元素的化合价+5价降低0价,得到5个电子,因此若1mol KNO,参加反应,转移电子的物质的量为5mol,D不正确,答案选C。
价,B不正确;C、6.5g氮化钠的物质的量是6.5g÷65g/mool=0.1mol,根据方程式可知反应中生成氮气的物质的量是0.16mol,则标准状况下氮气的体积是0.16mol×22.4L/mol=3.584L,C正确;D、硝酸钾中氮元素的化合价+5价降低0价,得到5个电子,因此若1mol KNO,参加反应,转移电子的物质的量为5mol,D不正确,答案选C。
考点:考查氧化还原反应的有关判断与计算

将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol/L;若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol/L的NaOH溶液的体积为:
| A.100mL | B.160mL | C.240mL | D.307mL |
去年下半年我省雾霾天气十分严重。PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO—催化剂→N2+CO2,下列关于此反应的说法中,不正确的是
| A.所涉及元素的第一电离能:N>O>C |
| B.当x=2时,每生成1molN2,转移电子数为4mol |
C.等物质的量N2和CO2中,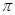 键的个数比为1:1 键的个数比为1:1 |
| D.氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
某金属和硝酸反应,已知参加反应的被还原的硝酸和参加反应的硝酸的物质的量之比为1∶6,若已知还原产物唯一,则还原产物为
| A.N2 | B.N2O | C.NO | D.NO2 |
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol—1
下列说法不正确的是:
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1 |
| B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同 |
| C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol |
1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是( )
| A.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| B.加入NaOH溶液的体积是50mL |
| C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08mol |
| D.得到的金属氢氧化物的沉淀为3.12克 |
物质的量之比为1∶3的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是 ( )。
| A.在此反应中硝酸体现强氧化性,全部被还原 |
| B.向反应后的溶液中再加入金属铁,不再发生化学反应 |
| C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4 |
| D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5 |
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
其中第①步中存在平衡:2CrO42- (黄色)+2H+??Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
| A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |