题目内容
下图是利用钛白粉生产海绵钛(Ti)的一种工艺流程:
有关说法正确的是( )
| A.反应Ⅰ中钛白粉(TiO2)做氧化剂 |
| B.该工艺中可以循环使用的物质只有Cl2 |
| C.可以用N2代替Ar作为反应Ⅱ中的保护气 |
D.反应Ⅱ的化学方程式为2Mg+TiCl4 2MgCl2+Ti 2MgCl2+Ti |
D
解析

某金属和硝酸反应,已知参加反应的被还原的硝酸和参加反应的硝酸的物质的量之比为1∶6,若已知还原产物唯一,则还原产物为
| A.N2 | B.N2O | C.NO | D.NO2 |
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol—1
下列说法不正确的是:
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1 |
| B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同 |
| C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol |
高温下焙烧CuFeS2的反应之一为:2CuFeS2+7O2 CuSO4+CuO+Fe2O3 +3SO2,
CuSO4+CuO+Fe2O3 +3SO2,
下列关于该反应的叙述正确的是
| A.CuFeS2中硫的化合价为-1 |
| B.CuFeS2发生还原反应 |
| C.1 mol CuFeS2完全反应转移13 mol电子 |
| D.CuSO4和SO2既是氧化产物,又是还原产物 |
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A.原混合物中铜和铁各0.15 mol |
| B.稀硝酸的物质的量浓度为1 mol/L |
| C.第一次剩余的9.6 g金属为铜和铁 |
| D.再加入上述200 mL稀硝酸,还能得到标准状况下2.24 L NO |
钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130 ℃反应。其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+=5H2O3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH下列说法正确的是( )。
| A.反应①不是氧化还原反应 |
| B.该生产过程不产生任何污染 |
| C.整个反应过程中,每有5.6 g Fe参加反应转移0.8 mol电子 |
| D.反应②中的氧化剂是NaNO2 |
已知:
①向KMnO4晶体中滴加浓盐酸,产生某黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断中正确的是( )
| A.①中产生气体的电子式是Cl?Cl |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验②中FeCl2被氧化 |
| D.实验③发生的是同主族元素单质间的置换反应 |
某研究小组在实验室用重晶石(主要成分BaSO4)对工业生产BaS进行模拟实验。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知:
BaSO4(s)+4C(s)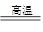 4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)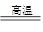 2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
下列说法不正确的是( )
| A.上述反应中BaSO4均作氧化剂 |
B.反应C(g)+CO2(g)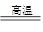 2CO(g)的ΔH3>+172.5 kJ·mol-1 2CO(g)的ΔH3>+172.5 kJ·mol-1 |
| C.实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 |
| D.以BaS作为沉淀剂,用于铅和汞沉淀的转化 |