题目内容
10.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应.
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑;CH≡CH+2Br2→CHBr2-CHBr2.
(2)甲同学设计的实验不能(填能或不能)验证乙炔与溴发生加成反应,其理由是ac(多选扣分).
a.使溴水褪色的反应,未必是加成反应 b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔 d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔必定含有一种杂质气体是H2S它与溴水反应的化学方程式是Br2+H2S═S↓+2HBr;在验证过程中必须全部除去.
d
(4)如图所示,请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品.
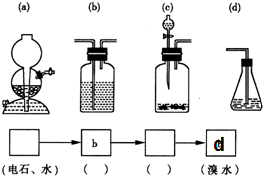
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应溶液的酸性,理由是如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
分析 (1)碳化钙能与水反应生成乙炔,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色;
(3)电石中含有硫化物,与水反应生成硫化氢气体;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔;
(5)根据取代反应的特征是:有去有回来回答.
解答 解:(1)碳化钙能与水反应生成乙炔和水,反应方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色,反应方程式为CH≡CH+2Br2→CHBr2-CHBr2,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;CH≡CH+2Br2→CHBr2-CHBr2;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色,故答案为:不能;ac;
(3)电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应生成硫和溴化氢,反应方程式为Br2+H2S═S↓+2HBr,
故答案为:H2S;Br2+H2S═S↓+2HBr;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔,
故答案为: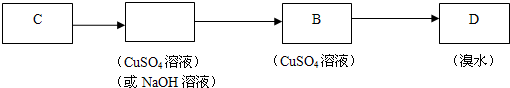
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证;
故答案为:如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
点评 本题考查了乙炔的制备和性质实验,题目难度不大,本题中注意乙炔的除杂和性质实验,注意与溴水反应的性质.

练习册系列答案
相关题目
20.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 10mL质量分数98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| D. | 1molCl2与足量的铁反应,转移的电子数为3NA |
1. 如图是M、N两种物质的溶解度曲线.t2℃时往盛有100g水的烧杯中先后加入ag M和ag N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌.降温至t1℃,下列说法正确的是( )
如图是M、N两种物质的溶解度曲线.t2℃时往盛有100g水的烧杯中先后加入ag M和ag N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌.降温至t1℃,下列说法正确的是( )
 如图是M、N两种物质的溶解度曲线.t2℃时往盛有100g水的烧杯中先后加入ag M和ag N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌.降温至t1℃,下列说法正确的是( )
如图是M、N两种物质的溶解度曲线.t2℃时往盛有100g水的烧杯中先后加入ag M和ag N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌.降温至t1℃,下列说法正确的是( )| A. | t2℃时,得到M的饱和溶液 | |
| B. | t2℃时,得到N的不饱和溶液 | |
| C. | 温度降低到t1℃时,得到M、N的不饱和溶液,且溶液中溶质的质量分数相等 | |
| D. | 温度降低到t1℃时,M、N的溶解度相等,得到M、N的饱和溶液 |
18.下列说法中正确的是( )
| A. | 组成上相差一个或若干个CH2原子团,且符合同一通式的有机物之间互称为同系物 | |
| B. | 淀粉、纤维素、天然油脂等都属于混合物 | |
| C. | 由于苯分子结构的特殊性,因此苯不能发生加成反应 | |
| D. | 丙烷分子中所有原子不在一个平面上,但3个碳原子在一直线上 |
5.一定质量的某有机物和足量的金属钠反应,可得到气体V1L,等质量的该有机物与足量的纯碱反应,可得到气体V2L.若同温同压下V1>V2(V2不为零),则该有机物可能是( )
| A. | HOCH2CH2COOH | B. | HOOC-COOH | C. | HOCH2CH2OH | D. | CH3COOH |
15.已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量.下列说法正确的是( )
| A. | 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,反应2SO2+O2═2SO3是一个放热反应,则反应2SO3═2SO2+O2是一个吸热反应 | |
| D. | 氯化氢分解成氢气和氯气时能够放出能量 |
2.下列说法中正确的是( )
| A. | 凡是物质的化学变化都伴随着能量的变化 | |
| B. | 凡是物质的化学变化就一定只伴随着化学能与热能的转化 | |
| C. | 凡是吸热反应都需要人为加热 | |
| D. | 任何放热反应在常温下一定能发生 |
19.关于“化学之最”,下列说法正确的是( )
①铝是地壳里含量最多的金属元素②第六周期是目前周期表中含元素最多的周期
③Na是短周期元素中原子半径最大的主族元素 ④F是非金属最强的元素.
①铝是地壳里含量最多的金属元素②第六周期是目前周期表中含元素最多的周期
③Na是短周期元素中原子半径最大的主族元素 ④F是非金属最强的元素.
| A. | 全对 | B. | 除①外全对 | C. | 除②外全对 | D. | 除③外全对 |
20.已知溶液中的反应3KSCN+FeCl3═Fe(SCN)3(血红色)+3KCl,下列说法正确的是( )
| A. | 向平衡体系中加入少量KCl固体或Fe(SCN)3固体,溶液红色都变浅 | |
| B. | 向平衡体系中加入少量FeCl3固体或KSCN固体,溶液红色加深 | |
| C. | 向平衡体系中加入水稀释,平衡不移动,但溶液红色变浅 | |
| D. | 该反应的离子方程式为:3KSCN+Fe3+═Fe(SCN)3(血红色)+3K+ |