题目内容
20.NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 10mL质量分数98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| D. | 1molCl2与足量的铁反应,转移的电子数为3NA |
分析 A、N2和CO的物质的量相等,但不一定是1mol;
B、求出双氧水的物质的量,然后根据1mol双氧水中含18mol电子来分析;
C、根据浓硫酸与稀硫酸的密度不同,稀释后硫酸的质量分数大于9.8%;
D、根据反应后氯元素变为-1价来分析.
解答 解:A、N2和CO的物质的量相等,但不一定是1mol,故等物质的量的两者的分子数相等,但不一定是NA个,故A错误;
B、17g双氧水的物质的量n=$\frac{1.7g}{34g/mol}$=0.05mol,而1mol双氧水中含18mol电子,故0.05mol双氧水中含0.9mol电子即0.9NA个,故B正确;
C、10mL质量分数为98%的H2SO4,用水稀释至100mL,由于硫酸溶液的密度大于水的密度,所以稀释后H2SO4的质量分数大于9.8%,故C错误;
D、与铁反应后氯元素变为-1价,故1mol氯气转移2mol电子即2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
3.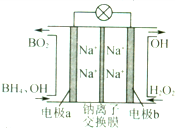 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )
 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其丁作原理如图所示.下列说法中错误的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极b采用Mn O2,Mn O2既做电极材料又有催化作用 | |
| C. | 该电池的负极反应为BH${\;}_{4}^{-}$+8OH-一8e-═BO${\;}_{2}^{-}$+6H2O | |
| D. | 每消耗3molH2O2,转移的电子为3mol |
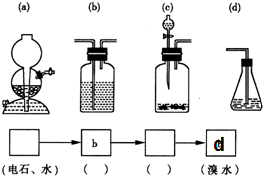
11. (1)指出使用如表仪器 (已洗净)或用品的第一步操作:
(1)指出使用如表仪器 (已洗净)或用品的第一步操作:
(2)配制物质的量浓度为0.2mol/LNaOH溶液500mL,请回答如表问题:
(3)下列操作导致配制的NaOH溶液浓度偏低的是AB.
A.称量时将NaOH固体直接放在纸上
B.将称量的NaOH固体露置在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.整个配制过程中容量瓶不振荡
(4)现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是分液、蒸馏、萃取分液.
(5)如图是实验室制取氯气的装置,请写出检查该装置气密性的操作方法:关闭分液漏斗活塞,向烧杯中加水没过导管口,微热圆底烧瓶,若导管口有气泡,且停止微热冷却后,导管口形成稳定的水柱,则装置的气密性良好..
 (1)指出使用如表仪器 (已洗净)或用品的第一步操作:
(1)指出使用如表仪器 (已洗净)或用品的第一步操作:| 淀粉-KI试纸检验气体 | 集气瓶收集氨气 | 容量瓶 |
| 用蒸馏水湿润 | 干燥集气瓶 | 检验是否漏水(检漏) |
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
A.称量时将NaOH固体直接放在纸上
B.将称量的NaOH固体露置在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.整个配制过程中容量瓶不振荡
(4)现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是分液、蒸馏、萃取分液.
(5)如图是实验室制取氯气的装置,请写出检查该装置气密性的操作方法:关闭分液漏斗活塞,向烧杯中加水没过导管口,微热圆底烧瓶,若导管口有气泡,且停止微热冷却后,导管口形成稳定的水柱,则装置的气密性良好..
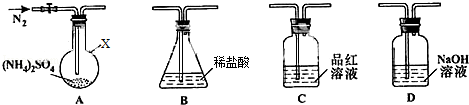
8.某学习小组利用下列装置进行CO2与饱和NaCO2溶液反应制备NaHCO3实验
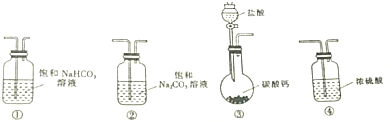
(1)选取必要的实验装置,正确的连接顺序为③①②(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3,小组同学提出下列实验方案
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象
乙方案:将样品溶液与BaCl4,观察现象
丙方案:测得pH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCl4溶液等体积混合进行实验,结果如下.
①此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.答:Q=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
[已知0.1mol•L-1NaHCO3溶液电离出的c(CO32-)为0.0011mol•L-1,Ksp(BaCO3)=5.1×10-9]
②产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案是取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH.
(3)某溶液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为:4.8×10-7,已知Ksp(AgCl)=1.8×10-10,Ksp(Agl)=8.5×10-17.

(1)选取必要的实验装置,正确的连接顺序为③①②(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3,小组同学提出下列实验方案
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象
乙方案:将样品溶液与BaCl4,观察现象
丙方案:测得pH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCl4溶液等体积混合进行实验,结果如下.
| NaHCO3溶液 BaCl3浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
[已知0.1mol•L-1NaHCO3溶液电离出的c(CO32-)为0.0011mol•L-1,Ksp(BaCO3)=5.1×10-9]
②产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案是取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH.
(3)某溶液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为:4.8×10-7,已知Ksp(AgCl)=1.8×10-10,Ksp(Agl)=8.5×10-17.
15.由铝屑与盐酸、氢氧化钠溶液反应制取1molAl(OH)3,最少需要消耗HC1和NaOH的物质的量为( )
| A. | 3 mol、3 mol | B. | 1 mol、1 mol | ||
| C. | 0.75 mol、0.75 mol | D. | 0.25 mol、0.25 mol |
12.下列有关铝及其化合物的性质叙述正确的是( )
| A. | 等质量的铝分别与足量的盐酸和足量的氢氧化钠溶液反应制得等质量的氢气 | |
| B. | 向氯化铝溶液中滴加过量氨水,最终得到澄清溶液 | |
| C. | 常温下铝、铁都可以与浓硝酸反应制得大量的NO2 | |
| D. | FeCl3溶液加热蒸干得到无水氯化铁晶体 |

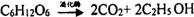 .
.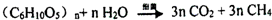 (已知:该反应条件为细菌,产生等物质的量的两种气体).
(已知:该反应条件为细菌,产生等物质的量的两种气体).