题目内容
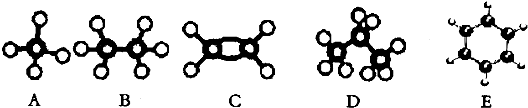
5.一定质量的某有机物和足量的金属钠反应,可得到气体V1L,等质量的该有机物与足量的纯碱反应,可得到气体V2L.若同温同压下V1>V2(V2不为零),则该有机物可能是( )| A. | HOCH2CH2COOH | B. | HOOC-COOH | C. | HOCH2CH2OH | D. | CH3COOH |
分析 等质量的该有机物与足量的Na2CO3反应,可得到气体V2L,说明有机物中含有-COOH,一定质量的某有机物和足量的金属钠反应,可得到气体V1L,且同温同压下V1>V2,说明还含有-OH,以此解答该题.
解答 解:-OH、-COOH都能与金属钠反应生成H2,1mol-OH或1mol-COOH与钠反应可产生0.5mol H2,
羟基不与碳酸钠反应,只有-COOH与Na2CO3反应生成CO2,1mol-COOH与Na2CO3反应可产生0.5mol CO2,
若同温同压下V1>V2(V2不为零),说明有机物与金属钠反应产生的气体的体积多于与纯碱反应产生的气体的体积,
则有机物结构中既有-COOH又有-OH,只有A符合,
故选A.
点评 本题考查有机物的结构与性质,题目难度中等,明确-COOH可与Na2CO3反应生成气体,而-OH不与NaHCO3反应为解答关键,注意熟练掌握常见有机物的结构与性质.

练习册系列答案
相关题目
15.由铝屑与盐酸、氢氧化钠溶液反应制取1molAl(OH)3,最少需要消耗HC1和NaOH的物质的量为( )
| A. | 3 mol、3 mol | B. | 1 mol、1 mol | ||
| C. | 0.75 mol、0.75 mol | D. | 0.25 mol、0.25 mol |
16.下列图示操作正确的是( )
| A. | 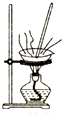 灼烧 | B. | 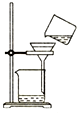 过滤 | ||
| C. | 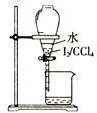 分液 | D. |  蒸馏 |
13.甲、乙两种固体物质的溶解度曲线如图所示.下列说法正确的是( )
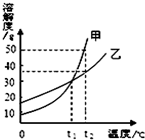

| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 升高温度可使甲的不饱和溶液变为饱和溶液 | |
| C. | t1℃时,甲、乙两种饱和溶液的溶质质量分数相等 | |
| D. | t2℃时,50g乙加入100g水中得到乙的不饱和溶液 |
17.下列叙述正确的是( )
| A. | 蚕丝、棉花和人造丝的主要成分都是纤维素 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物,能发生水解反应 | |
| C. | “地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物合理利用 | |
| D. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |