题目内容
【题目】下列离子方程式中,书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.稀硫酸与氢氧化钡溶液反应:Ba2++H++OH-+![]() =H2O+BaSO4↓
=H2O+BaSO4↓
C.在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.铜片跟硝酸银溶液反应:Cu+2Ag+=Cu2++2Ag
【答案】D
【解析】
A.铁与稀盐酸反应生成氯化亚铁,反应的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.稀硫酸与氢氧化钡溶液反应生成硫酸钡和水,反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B错误;
C.在澄清石灰水中通入过量的CO2,反应生成碳酸氢钙溶液,反应的离子方程式为OH-+CO2=HCO3-,故C错误;
D.硝酸银溶液与铜反应生成银和铜离子,反应的离子方程式为:2Ag++Cu═2Ag+Cu2+,故D正确;
故答案选D。

【题目】严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:
(1)用活性炭对尾气进行处理,发生如下反应:
反应a:C(s)+NO2(g)![]() 1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
反应b:2C(s)+N2O4(g)![]() N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
则NO2生成N2O4的热化学方程式为____。
(2)用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 物质 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 /td> |
①15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是___(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
②0~10 min内,CO2的平均反应速率v(CO2)=___。
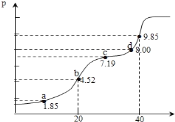
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在密闭容器中加入足量的C和一定量的N2O4气体,维持温度T2℃,在不同压强下发生(1)中反应b,经过相同时间N2O4的转化率随压强变化如图所示:

在1.1×106 Pa时该反应的化学平衡常数Kp=___(结果保留两位有效数字。已知:气体分压(p分)=气体总压(p总)×体积分数)。
(4)用I2O5吸收汽车尾气中的CO,发生I2O5(s)+5CO(g)![]() 5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
①测得CO的平衡转化率随温度变化的关系如图,下列说法正确的是____(填字母)。

A.Q<0
B.从X点到Y点可通过通入CO实现
C.从Y点到Z点可通过增大压强实现
D.600 K时,Y点CO的v正<v逆
②已知Y点的坐标为(600K,0.6),在此条件下I2(g)的体积分数为___。(精确到0.1%)
【题目】测定![]() 溶液先升温再降温过程中的
溶液先升温再降温过程中的![]() ,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的
,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的![]() 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
时刻 | ① | ② | ③ | ④ |
温度 | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() 溶液中存在水解平衡:
溶液中存在水解平衡:![]()
B. ④产生的白色沉淀是![]()
C. ①→③的过程中,![]() 在降低
在降低
D. ①→③的过程中,温度与![]() 相比,前者对水解平衡的影响更大
相比,前者对水解平衡的影响更大