题目内容
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19,常温下用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH值,横坐标表示V(NaOH)).下列说法不正确的是( )
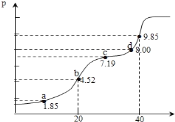
A. a点所得溶液中;2n(H2A)+n(A2-)=0.002mol
B. b点所得溶液中:c(H2A)+c(H+)=c(A2-)+c(OH-)
C. c点所得溶液中:c(Na+)<3c(HA-)
D. d点所得溶液中:c(Na+)>c(A2-)>c(HA-)
【答案】C
【解析】
根据中和反应过程所得溶液的三大守恒关系分析解题,其中质子守恒可看作是电荷守恒、物料守恒合并得到。
A项:曲线上任意点对应的溶液都符合物料守恒n(H2A)+n(HA-)+n(A2-)=0.020L×0.1molL-1=0.002mol。a点溶液pH=pKa1=1.85,代入Ka1表达式得c(H2A)=c(HA-),有n(H2A)=n(HA-),故2n(H2A)+n(A2-)=0.002mol,A项正确;
B项:b点溶液中溶质为NaHA,电荷守恒c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),物料守恒c(H2A)+c(HA-)+c(A2-)=c(Na+),两式相加得质子守恒c(H2A)+c(H+)=c(A2-)+c(OH-),B项正确;
C项:据电荷守恒c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),c点pH=7.19溶液呈碱性c(H+)<c(OH-),则c(Na+)>c(HA-)+2c(A2-)。将pH=pKa2=7.19代入Ka2表达式得c(A2-)=c(HA-),故c(Na+)>3c(HA-),C项错误;
D项:d点溶液中溶质为NaHA、Na2A,c(Na+)最大。c点溶液中c(A2-)=c(HA-),从c点到d点,加NaOH溶液发生反应HA—+OH-=A2-+H2O,故d点溶液中c(A2-)>c(HA-),D项正确。
本题选C。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
【题目】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(l)+CO2(g) | H2NCOONH4(l)
|
快速放热 | 慢速吸热 |
(1)写出制备尿素的总反应化学方程式:____________________________,该反应热为![]() ,则
,则![]() ______________(“大于”“小于”或“等于”)
______________(“大于”“小于”或“等于”)![]() 。
。
(2)下列说法正确的是________________。
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比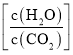 有利于尿素的生成
有利于尿素的生成
D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为![]() 时(
时(![]() ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比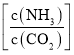 的变化如表所示:
的变化如表所示:
氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
尿素平衡转化率/% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是_____________。氨碳比为3.50时,求该状态下的制备尿素总反应平衡常数K=___________.
(4)一定条件下,在图中绘制氨基甲酸铵(![]() )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。
 _______________
_______________
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________________________.