题目内容
【题目】据下列信息完成所需回答的问题:
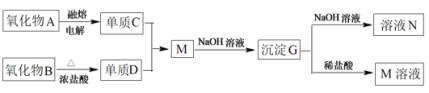
其中氧化物A是白色固体;氧化物B是黑色固体;单质D为有毒的黄绿色气体,单质C不溶于冷的浓硝酸。
(1)D是_______;G是_______(填化学式)
(2)写出下列反应的离子方程式:M+NaOH溶液生成G_____________________、G+NaOH溶液生成N______________________________________________________。
(3)单质C不溶于冷的浓硝酸的原因是____________________________。
【答案】Cl2 Al(OH)3 Al3++3OH–=Al(OH)3↓ Al(OH)3+OH–=AlO2–+2H2O 铝在冷的浓硝酸中表面形成致密的氧化物保护膜,阻止了铝和浓硝酸的反应
【解析】
氧化物A是白色固体,电解熔融A生成单质C,单质C不溶于冷的浓硫酸,常温下能与冷的浓硫酸发生钝化现象的是Fe、Al,但只有氧化铝是白色固体,所以C是Al、A是Al2O3;氧化物B是黑色固体,和浓盐酸在加热条件下反应生成单质D为有毒的黄绿色气体,所以D是Cl2,能和浓盐酸共热生成氯气的黑色氧化物B是MnO2,D能和Al反应生成AlCl3,M能和NaOH溶液生成沉淀G为Al(OH)3,G溶于NaOH溶液得到N为NaAlO2,G和稀盐酸反应生成M,据此分析解答。
根据以上分析可知A是Al2O3,B是MnO2,C是Al,D是Cl2,G为Al(OH)3,M是AlCl3,N是NaAlO2,则
(1)通过以上分析知,D、G的化学式分别是Cl2、Al(OH)3;
(2)氯化铝与氢氧化钠溶液反应生成氢氧化铝的离子方程式为Al3++3OH–=Al(OH)3↓;氢氧化铝溶于氢氧化钠溶液生成偏铝酸钠和水的离子方程式为Al(OH)3+OH–=AlO2–+2H2O;
(3)常温下铝和冷的浓硝酸发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,因此常温下单质铝不溶于冷的浓硝酸中。

 阅读快车系列答案
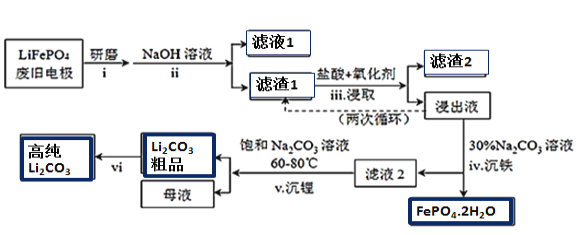
阅读快车系列答案【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程如图:
资料:碳酸锂在水中溶解度随温度变化如下:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是__________________。
(2)过程ii加入足量NaOH溶液的作用(用化学反应方程式表示)_________________。
(3)如过程iii采用NaClO3作为氧化剂,则过程中会反应会发生副反应生成黄绿色气体,
①该副反应对应的离子方程式为_______________________________________________________;
从环保角度分析,选择___________(填字母)作为该过程的氧化剂会更好。
a.H2O2 b.浓硫酸 c.浓HNO3
②过程iii得到的浸出液循环两次的目的是________________________________________________。
(4)浸出液中存在大量H2PO4﹣和HPO42-,已知:![]() ,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
(5)简述过程vi的操作______________________________________________________________。