题目内容
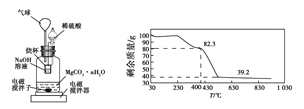
【题目】测定![]() 溶液先升温再降温过程中的
溶液先升温再降温过程中的![]() ,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的
,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的![]() 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
时刻 | ① | ② | ③ | ④ |
温度 | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() 溶液中存在水解平衡:
溶液中存在水解平衡:![]()
B. ④产生的白色沉淀是![]()
C. ①→③的过程中,![]() 在降低
在降低
D. ①→③的过程中,温度与![]() 相比,前者对水解平衡的影响更大
相比,前者对水解平衡的影响更大
【答案】D
【解析】
A. ![]() 是强碱弱酸盐,溶液中
是强碱弱酸盐,溶液中![]() 会水解;
会水解;
B.难溶于强酸的沉淀是![]() ;
;
C.①→③升温,氧气和亚硫酸根的反应速率加快,![]() 降低,溶液PH减小;
降低,溶液PH减小;
D. ①→③的过程中,看溶液PH变化判断![]() 降低与温度升高哪个影响更大;
降低与温度升高哪个影响更大;
A. ![]() 是强碱弱酸盐,
是强碱弱酸盐,![]() 会水解:
会水解:![]() ,A项正确;
,A项正确;
B.加入盐酸酸化的![]() 溶液做对比实验,④产生白色沉淀多。这种难溶于强酸的白色沉淀是
溶液做对比实验,④产生白色沉淀多。这种难溶于强酸的白色沉淀是![]() ,B项正确;
,B项正确;
C.升温氧气和亚硫酸根2![]() +O2=2
+O2=2![]() 2-的反应速率加快,导致
2-的反应速率加快,导致![]() 降低,水解的c(OH-)减少,溶液PH减小,C项正确;
降低,水解的c(OH-)减少,溶液PH减小,C项正确;
D.温度升高平衡正移,溶液PH会增大。![]() 降低会导致溶液PH减小。①→③的过程中PH减小,所以后者影响更大,D项错误;
降低会导致溶液PH减小。①→③的过程中PH减小,所以后者影响更大,D项错误;
答案选D。

 阅读快车系列答案
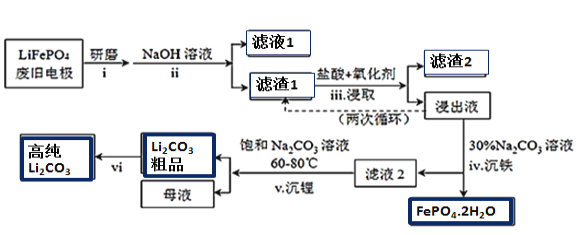
阅读快车系列答案【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程如图:
资料:碳酸锂在水中溶解度随温度变化如下:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是__________________。
(2)过程ii加入足量NaOH溶液的作用(用化学反应方程式表示)_________________。
(3)如过程iii采用NaClO3作为氧化剂,则过程中会反应会发生副反应生成黄绿色气体,
①该副反应对应的离子方程式为_______________________________________________________;
从环保角度分析,选择___________(填字母)作为该过程的氧化剂会更好。
a.H2O2 b.浓硫酸 c.浓HNO3
②过程iii得到的浸出液循环两次的目的是________________________________________________。
(4)浸出液中存在大量H2PO4﹣和HPO42-,已知:![]() ,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
(5)简述过程vi的操作______________________________________________________________。
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。