题目内容
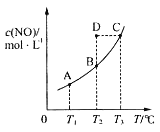
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1CH3COOH溶液所得滴定曲线如图。下列说法正确的是( )

A.①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
B.②所示溶液中:c(Na+)=c(CH3COO-)
C.③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
【答案】B
【解析】
A.①点溶液中溶质为等物质的量浓度的CH3COOH和CH3COONa,存在物料守恒2c(Na+)=c(CH3COOH)+c(CH3COO-),故A错误;
B.②点溶液pH=7,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),根据电荷守恒得c(Na+)=c(CH3COO-),故B正确;
C.③点溶液中溶质为醋酸钠,醋酸根离子水解导致溶液呈碱性,但是其水解程度较小,所以存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.加入的NaOH后,溶液中一定含有溶质醋酸钠,溶液中一定存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),所以不可能存在c(CH3COO-)>c(Na+)>c(OH-)>c(H+),故D错误;
故选B。

【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
下列说法正确的是
容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 设k为该反应的化学平衡常数,则有k=k逆:k正
B. 达平衡时,容器Ⅱ与容器Ⅲ中的总压强之比为20∶17
C. 容器Ⅱ中起始平衡正向移动,达平衡时,容器Ⅱ中NO2的转化率比容器Ⅰ中的小
D. 若改变温度为T2,且T2>T1,则k正:k逆<0.8