题目内容
8. 铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )| A. | 放电时,负极质量减小,正极质量增大 | |
| B. | 放电时,当电路中通过2mol e-时,消耗2mol H2SO4 | |
| C. | 放电时,溶液中SO${\;}_{4}^{2-}$向正极区移动 | |
| D. | 放电时,整个电解质溶液的pH逐渐变大 |
分析 铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,据此分析解答.
解答 解:A.放电时负极发生为Pb-2e-+SO42-=PbSO4,生成PbSO4,则质量增大,故A错误;
B.总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O,可知当电路中通过2mol e-时,消耗2mol H2SO4,故B正确;
C.放电时阴离子向负极移动,阳离子向正极移动,故C错误;
D.根据PbO2+2H2SO4+Pb═2PbSO4+2H2O知,硫酸参加反应,则c(H+)逐渐减小,pH逐渐增大,故D错误.
故选B.
点评 本题考查了化学电源新型电池,根据电池反应式中元素化合价变化确定正负极,书写电极反应式是学习难点,根据电极反应式确定溶液酸碱性变化,知道离子移动方向,难度不大.

练习册系列答案
相关题目
18.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 加NaOH后加热有气体放出且有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- | |
| C. | 与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| D. | 遇苯酚显紫色的溶液:I-、K+、SO42-、Mg2+ |
19.如图所示,下列叙述正确的是( )
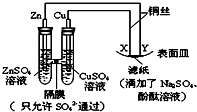

| A. | Y为阴极,发生还原反应 | B. | X为正极,发生氧化反应 | ||
| C. | 锌电极表面有红色的铜析出 | D. | X与滤纸接触处变红 |
3.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Fe2(SO4)3溶液 |
13.下列说法正确的是( )
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4 比H2SiO3 的酸性强 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数目为3NA | |
| B. | 标准状态下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为$\frac{5}{3}$NA |
2.X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( )
| A. | 只含极性键的共价化合物 | |
| B. | 含非极性键的共价化合物 | |
| C. | 阴阳离子个数之比为1:1的离子化合物 | |
| D. | 可形成双核离子或者四核离子 |
3.下列有关电化学原理的说法错误的是( )
| A. | 可充电的电池称“二次电池”,在充电时,是将电能装化为化学能,在放电时,又将化学能转化为电能 | |
| B. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| C. | 对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 | |
| D. | 氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |