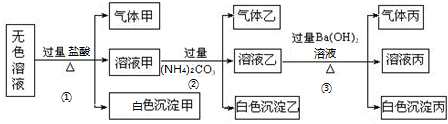
题目内容
13.下列说法正确的是( )| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4 比H2SiO3 的酸性强 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
分析 A.非金属性越强,气态氢化物越稳定;
B.非金属性越强,最高价氧化物的水化物酸性越强;
C.浓硫酸具有强氧化性;
D.高锰酸钾溶液能将催熟水果的乙烯氧化.
解答 解:A.I的原子半径大于Br,非金属性Br>I,则HBr比HI的热稳定性强,故A错误;
B.P的非金属性强于Si,可知H3PO4 比H2SiO3 的酸性强,故B正确;
C.增大反应物浓度可加快反应速率,但浓硫酸具有强氧化性,浓硫酸与铁反应不生成氢气,故C错误;
D.高锰酸钾溶液能将催熟水果的乙烯氧化,可用浸泡过高锰酸钾溶液的硅藻土保存水果,故D正确;
故选BD.
点评 本题考查元素周期律和元素周期表的应用,为高频考点,涉及元素的位置、性质、反应速率及氧化还原反应等,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.下列情况能通过置换反应得到金属铁的是( )
| A. | Na与FeCl2溶液常温混合 | B. | CO通过灼热的Fe2O3 | ||
| C. | H2通入FeSO4溶液 | D. | Al和Fe3O4混合加热至高温 |
4.用蒸馏水润湿pH试纸(每一次使用时润湿程度相同)测定溶液的pH,下列说法正确的是( )
| A. | 测定值一定有误差 | |
| B. | 测定值一定没有误差 | |
| C. | 测出的Na2CO3溶液的pH偏小 | |
| D. | 用此方法测H+浓度相同的盐酸和醋酸时,盐酸的pH比醋酸小 |
1.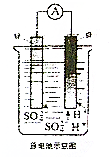 如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )
如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )
 如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )
如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )| A. | 锌片是原电池负极 | B. | 溶液逐渐变为蓝色 | ||
| C. | H+在负极得到电子被还原 | D. | 锌片越纯,锌片上产生的气泡越多 |
8. 铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
 铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )| A. | 放电时,负极质量减小,正极质量增大 | |
| B. | 放电时,当电路中通过2mol e-时,消耗2mol H2SO4 | |
| C. | 放电时,溶液中SO${\;}_{4}^{2-}$向正极区移动 | |
| D. | 放电时,整个电解质溶液的pH逐渐变大 |
18.下列金属的冶炼,均不能用热还原法制得一组是( )
| A. | Na、Ca、Mg、Al、K | B. | Na、K、Zn、Fe、Hg | C. | Zn、Fe、Cu、Ag、Sn | D. | Mg、Al、Zn、Fe、Pb |
8.下列说法中,不正确的是( )
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. |  和 和 属于同一种物质 属于同一种物质 | D. | CH4和C2H6互为同系物 |