题目内容
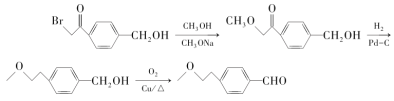
【题目】倍他乐克是一种治疗高血压的药物,其中间体F合成路线如下:

回答下列问题:
(1)A的分子式为____ 。 D中官能团的名称是____ 。
(2)B与足量NaOH溶液反应的化学方程式为____。
(3)D→E的反应类型为_____。
(4)反应⑤加入试剂X反应后只生成中间体F,则X结构简式为 ___。
(5)满足下列条件的C的同分异构体有_____种。
①能发生银镜反应;
②与NaOH溶液反应时,1molC最多消耗3molNaOH;
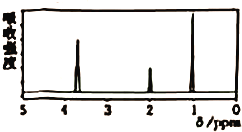
③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位。其中核磁共振氢谱有4种不同化学环境的氢,且峰面积比为1︰6︰2︰1的可能是____(写结构简式)。
(6)根据已有知识及题目相关信息,完成以 和CH3OH、CH3ONa为原料制备
和CH3OH、CH3ONa为原料制备 的合成路线流程图(无机试剂任选)____。
的合成路线流程图(无机试剂任选)____。
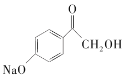
【答案】C8H8O2 羟基、醚键  +2NaOH
+2NaOH![]()
 +NaBr+H2O 取代反应 (CH3)2CHNH2 7
+NaBr+H2O 取代反应 (CH3)2CHNH2 7  和
和
【解析】
(1)根据A的键线式可知其分子式;由结构可知D中的官能团;
(2)B中含有酚羟基和溴原子,都可以与NaOH反应;
(3)根据D、E物质的结构简式,分析反应特点;
(4)根据EF的结构简式,分析反应的特点和规律,找出X的结构简式;
(5)C的分子式为C9H10O3,同分异构体满足:①能发生银镜反应,说明含有-CHO;②与NaOH溶液反应时,1molC最多消耗3molNaOH,而只含有3个O原子,说明分子中含有酚羟基,但由于含有-CHO,所以不可能有三个羟基,则只能是含有酯基,酯基水解生成甲酸和酚羟基;③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位,根据分子式可知4个取代基分别为-OOCH,-OH和两个-CH3,两个甲基处于间位,据以上分析写出同分异构体的结构简式;
(6)观察原料和目标产物可知,羟基被氧化,苯环上另一个取代基发生类似B到D的变化,据此写出合成路线。
(1)根据A的键线式可知其分子式为C8H8O2;根据D的结构简式可知其官能团为羟基、醚键;
(2)B中含有酚羟基和溴原子,都可以与NaOH反应,方程式为: +2NaOH
+2NaOH![]()
 +NaBr+H2O;
+NaBr+H2O;
(3)D到E的转化过程中D中酚羟基上的氢原子被取代,为取代反应;
(4)反应⑤加入试剂X反应后只生成中间体F,该过程中环打开,开环后两端O原子连接一个氢原子,另一端碳原子连接(CH3)2CHNH-,所以X为(CH3)2CHNH2;
(5)C的分子式为C9H10O3,同分异构体满足:
①能发生银镜反应,说明含有-CHO;
②与NaOH溶液反应时,1molC最多消耗3molNaOH,而只含有3个O原子,说明分子中含有酚羟基,但由于含有-CHO,所以不可能有三个羟基,则只能是含有酯基,酯基水解生成甲酸和酚羟基;
③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位,根据分子式可知4个取代基分别为-OOCH,-OH和两个-CH3,两个甲基处于间位,满足条件的同分异构体有: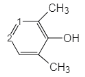 、
、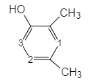 、
、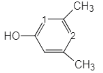 (数字表示-OOCH的位置),共有2+3+2=7种,峰面积比为1︰6︰2︰1的为:
(数字表示-OOCH的位置),共有2+3+2=7种,峰面积比为1︰6︰2︰1的为: 和
和 ;
;
(6)观察原料和目标产物可知,羟基被氧化,苯环上另一个取代基发生类似B到D的变化,所以合成路线为: 。
。

【题目】氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。
(1)写出实验室制取氨气的化学方程式_____。
(2)工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
过程中能量变化如图所示。
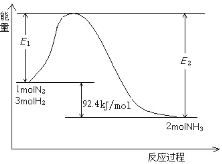
①该反应是_____反应。(填“放热”或“吸热”)
②在反应体系中加入催化剂,E2会_____。(填“增大”或“减小”或“不变”)
③若要增大NH3产率,可采取的措施有_____。(填字母)
a.升高温度 b.增大压强 c.不断分离出NH3
(3)利用如图所示装置探究NH3能否被NO2氧化。
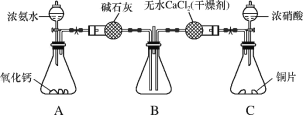
①C装置中制取NO2反应的离子方程式是_____。
②某同学认为NH3能被NO2氧化,且全部生成无毒物质,预期观察到B装置中红棕色消失。下表为不同时间下观察到的现象。
时间 | 1分钟 | 2分钟 | 3分钟 |
现象 | 红棕色未消失 | 红棕色未消失 | 红棕色未消失 |
请分析没有达到预期现象可能的原因(任写两条)_____、_____。
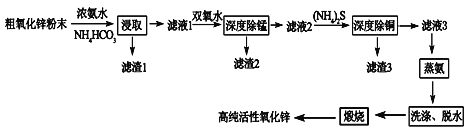
【题目】活性氧化锌(ZnO)广泛用于橡胶、涂料、陶瓷、电子等行业,以粗氧化锌(主要成分为ZnO,还含有少量MnO、CuO、FeO、Fe2O3等)为原料经深度净化可制备高纯活性氧化锌,其流程如图所示:
几种难溶物的Ksp:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 1.9×10-13 | 8.0×10-16 | 4.0×10-38 | 2.5×10-22 | 6.4×10-36 |
(1)将大小为66nm的高纯活性氧化锌粉末分散到水中,所得分散系为______。
(2)“浸取”过程中ZnO与NH3·H2O、NH4HCO3反应生成可溶性的Zn[(NH3)n]CO3和H2O。若有1mol ZnO溶解,则在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值为___________(已知:1≤n≤4)。
(3)“深度除锰”过程中双氧水可将“滤液1”中的Mn(OH)2转化为更难溶的MnO2·H2O,写出反应的化学方程式______________,“滤渣2”中存在的物质除了MnO2·H2O还可能含有_________(用化学式表示)。
(4)“深度除铜”过程中当溶液中![]() ≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
(5)“蒸氨”过程中Zn[(NH3)n]CO3分解为ZnCO3·2Zn(OH)2·H2O、NH3和CO2。为了提高经济效益,请设计循环利用NH3和CO2方案_____________。
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,写出反应的化学方程式______