题目内容
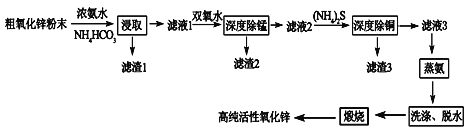
【题目】活性氧化锌(ZnO)广泛用于橡胶、涂料、陶瓷、电子等行业,以粗氧化锌(主要成分为ZnO,还含有少量MnO、CuO、FeO、Fe2O3等)为原料经深度净化可制备高纯活性氧化锌,其流程如图所示:
几种难溶物的Ksp:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 1.9×10-13 | 8.0×10-16 | 4.0×10-38 | 2.5×10-22 | 6.4×10-36 |
(1)将大小为66nm的高纯活性氧化锌粉末分散到水中,所得分散系为______。
(2)“浸取”过程中ZnO与NH3·H2O、NH4HCO3反应生成可溶性的Zn[(NH3)n]CO3和H2O。若有1mol ZnO溶解,则在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值为___________(已知:1≤n≤4)。
(3)“深度除锰”过程中双氧水可将“滤液1”中的Mn(OH)2转化为更难溶的MnO2·H2O,写出反应的化学方程式______________,“滤渣2”中存在的物质除了MnO2·H2O还可能含有_________(用化学式表示)。
(4)“深度除铜”过程中当溶液中![]() ≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
(5)“蒸氨”过程中Zn[(NH3)n]CO3分解为ZnCO3·2Zn(OH)2·H2O、NH3和CO2。为了提高经济效益,请设计循环利用NH3和CO2方案_____________。
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,写出反应的化学方程式______
【答案】胶体 3:1 Mn(OH)2+H2O2=MnO2·H2O↓+H2O Fe(OH)3 3.2×10-30 用水吸收NH3和CO2使之转化为NH4HCO3 ZnCO3·2Zn(OH)2![]() 3ZnO+CO2↑+2H2O
3ZnO+CO2↑+2H2O
【解析】
(1) 按分散质粒子高纯活性氧化锌粉末大小为66nm判断所得分散系类型;
(2) 按“浸取”过程中提供的反应物和生成物信息,书写方程式,据此判断在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值;
(3)按提供的反应物和生成物信息书写“深度除锰”过程中双氧水与Mn(OH)2反应的化学方程式,从流程和题给信息判断“滤渣2”其它的沉淀;
(4)根据![]() ≤2.0×10-6、溶液中Zn2+浓度为1mol/L以及溶度积常数,可求的最终溶液中S2-的浓度的最小值;
≤2.0×10-6、溶液中Zn2+浓度为1mol/L以及溶度积常数,可求的最终溶液中S2-的浓度的最小值;
(5)循环利用NH3和CO2,主要考虑氨水吸收二氧化碳时生成什么物质,结合流程图中相关物质回答;
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,参考碳酸盐和不溶性碱或碱式盐受热分解的产物书写该反应的化学方程式;
(1)分散质粒子高纯活性氧化锌粉末大小为66nm,在1 nm到100nm 之间,所得分散系为胶体;
答案为:胶体;
(2) 按信息,“浸取”过程中反应:ZnO+(n-1)NH3·H2O+NH4HCO3=Zn[(NH3)n]CO3+nH2O,在该转化反应中,若有1mol ZnO溶解,则参加反应的NH3·H2O和NH4HCO3物质的量之比为(n-1):1,当n=4时,比值达最大值;
答案为:3:1;
(3)按提供的反应物和生成物信息,“深度除锰”过程中双氧水把Mn(OH)2氧化得到MnO2·H2O沉淀,双氧水是绿色氧化剂,故该化学方程式为Mn(OH)2+H2O2=MnO2·H2O↓+H2O;
答案为:Mn(OH)2+H2O2=MnO2·H2O↓+H2O;
从流程看,滤液1中含有亚铁,也被双氧水氧化为Fe(OH)3沉淀,故滤渣中也含有氢氧化铁沉淀;
答案为:Fe(OH)3;
(4)根据![]() ≤2.0×10-6、溶液中Zn2+浓度为1mol/L,则c(Cu2+)≤2.0×10-6,CuS的溶度积常数为6.4×10-36,则
≤2.0×10-6、溶液中Zn2+浓度为1mol/L,则c(Cu2+)≤2.0×10-6,CuS的溶度积常数为6.4×10-36,则![]() ,故S2-的浓度的最小值为3.2×10-30 mol/L ;
,故S2-的浓度的最小值为3.2×10-30 mol/L ;
答案为:3.2×10-30 ;
(5)要循环利用NH3和CO2,结合流程图中可知把它们转变为碳酸氢铵,故循环利用NH3和CO2的方案为用水吸收NH3和CO2使之转化为NH4HCO3 ;
答案为:用水吸收NH3和CO2使之转化为NH4HCO3 ;
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,因为碳酸盐和不溶性碱或碱式盐受热分解生成金属氧化物、二氧化碳和水,则该反应方程式为ZnCO3·2Zn(OH)2![]() 3ZnO+CO2↑+2H2O;
3ZnO+CO2↑+2H2O;
答案为:ZnCO3·2Zn(OH)2![]() 3ZnO+CO2↑+2H2O。
3ZnO+CO2↑+2H2O。

【题目】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①在T℃下,0~2s时,该反应的平均反应速率![]() =________;
=________;
②该温度下反应的平衡常数K=________,在T℃下,能提高NO的平衡转化率的措施有_______、________。
(3)已知NO和O2反应的历程如图,回答下列问题:
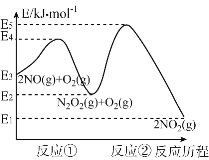
①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____(选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________。
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
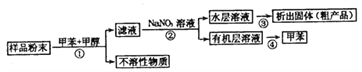
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D