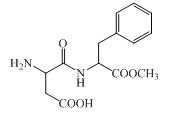
题目内容
【题目】氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。
(1)写出实验室制取氨气的化学方程式_____。
(2)工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
过程中能量变化如图所示。
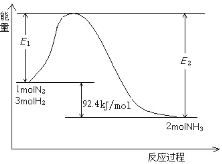
①该反应是_____反应。(填“放热”或“吸热”)
②在反应体系中加入催化剂,E2会_____。(填“增大”或“减小”或“不变”)
③若要增大NH3产率,可采取的措施有_____。(填字母)
a.升高温度 b.增大压强 c.不断分离出NH3
(3)利用如图所示装置探究NH3能否被NO2氧化。
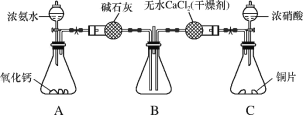
①C装置中制取NO2反应的离子方程式是_____。
②某同学认为NH3能被NO2氧化,且全部生成无毒物质,预期观察到B装置中红棕色消失。下表为不同时间下观察到的现象。
时间 | 1分钟 | 2分钟 | 3分钟 |
现象 | 红棕色未消失 | 红棕色未消失 | 红棕色未消失 |
请分析没有达到预期现象可能的原因(任写两条)_____、_____。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 放热 减小 bc Cu+4H++2NO3-=Cu2++2NO2↑+2H2O NO2氧化性较弱,不能将NH3氧化 在此条件下,NH3的转化率极低
CaCl2+2NH3↑+2H2O 放热 减小 bc Cu+4H++2NO3-=Cu2++2NO2↑+2H2O NO2氧化性较弱,不能将NH3氧化 在此条件下,NH3的转化率极低
【解析】
(1)实验室制取氨气的原理是利用固体氯化铵和氢氧化钙加热反应生成;
(2)①根据图示反应物和生成物能量的相对大小进行判断;
②催化剂降低化学反应的活化能;
③从化学平衡移动的角度进行分析;
(3)①铜和浓硝酸反应生成硝酸铜、二氧化氮和水,根据离子方程式书写规则书写;
②实验过程中,未能观察到C装置中的预期现象,说明二氧化氮反应的量很少,可能是反应速率降低,或者二氧化氮的转化率较低。
(1)实验室制取氨气的原理是利用固体氯化铵和氢氧化钙加热反应生成,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)①由图示可知,生成物能量低于反应物的能量,故该反应放热;
②加入催化剂会降低反应的活化能,导致E2减小;
③a.由图示可知,该反应为放热反应,升高温度,平衡逆向移动,NH3产率降低,故不选;
b.该反应的正反应为气体体积减小的反应,增大压强,平衡正向移动,NH3产率增大,可选;
c.不断分离出NH3,会促使反应正向进行,NH3产率增大,故选;
故答案选bc。
(3)①浓硝酸和铜反应生成硝酸铜、二氧化氮和水,离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②造成未能观察到C装置中的预期现象可能原因是:NO2氧化性较弱,不能将NH3氧化;在此条件下,NH3的转化率极低;反应速率慢;通入的 NO2过量等。

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
【题目】下面是A~G七种元素的电子排布:
元素 电子排布 电子层 | A | B | C | D | E | F | G |
K | 1 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 4 | 5 | 6 | 8 | 8 | 8 | |
M | 1 | 3 | 7 |
试根据由上述元素构成的物质的化学式回答下列问题。
(1)写出一种常见的由非极性键形成的双原子分子:____________________。
(2)写出一种由极性键形成的双原子分子:____________________。
(3)写出一种由极性键形成的三原子分子:____________________。
(4)写出一种由三种元素形成的既含离子键又含共价键的化合物:__________,其电子式为____________________。
(5)写出一种既含离子键又含非极性键的化合物:__________,其电子式为__________。