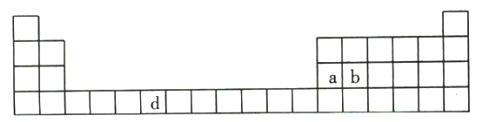
题目内容
【题目】S与O可形成![]() 。
。
(1)![]() 的空间构型为_____________________。
的空间构型为_____________________。
(2)写出一种与![]() 互为等电子体的分子的化学式:____________________。
互为等电子体的分子的化学式:____________________。
【答案】正四面体 CCl4(或SiCl4,其他合理答案也可)
【解析】
(1)由中心原子的杂化方式及与它形成共价键的原子个数,便可确定![]() 的空间构型。
的空间构型。
(2)分析![]() 的原子总数和价电子总数,依据“就近原则”,可确定它的等电子体的化学式。
的原子总数和价电子总数,依据“就近原则”,可确定它的等电子体的化学式。
(1)![]() 的中心原子S的价电子对数
的中心原子S的价电子对数![]() ,孤电子对数
,孤电子对数![]() ,S采用
,S采用![]() 杂化,
杂化,![]() 的空间构型为正四面体。答案为:正四面体;
的空间构型为正四面体。答案为:正四面体;
(2)与![]() 互为等电子体的分子应为AB4型结构,且中心A原子的价电子对数为30。我们可把显负价的元素定为F或Cl,从而得出中心原子可能为C或Si,一种与
互为等电子体的分子应为AB4型结构,且中心A原子的价电子对数为30。我们可把显负价的元素定为F或Cl,从而得出中心原子可能为C或Si,一种与![]() 互为等电子体的分子的化学式CCl4(或SiCl4,其他合理答案也可)。答案为:CCl4(或SiCl4,其他合理答案也可)。
互为等电子体的分子的化学式CCl4(或SiCl4,其他合理答案也可)。答案为:CCl4(或SiCl4,其他合理答案也可)。

练习册系列答案
相关题目