题目内容
【题目】工业上用CO、CO2均可以生产甲醇。CO在一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
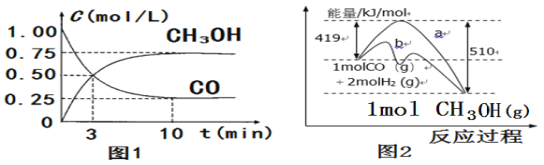
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=___;
(2)图2表示该反应进行过程中能量的变化,请根据图像写出反应的热化学方程式:___;
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH-―4e-=O2↑+2H2O,则阴极反应式为:___;
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
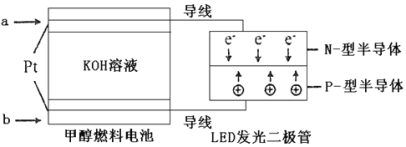
请写出加入(通入)a物质一极的电极反应式___。
【答案】0.15mol/(L·min) CO(g)+2H2(g)![]() CH3OH(g) △H=-91kJ/mol 2CO2+2H2O+4e-=2CO+4OH- CH3OH+8OH--6e-=CO32-+6H2O
CH3OH(g) △H=-91kJ/mol 2CO2+2H2O+4e-=2CO+4OH- CH3OH+8OH--6e-=CO32-+6H2O
【解析】
(1)依据速率公式进行计算;
(2)根据热化学反应方程式的特点进行分析解答;
(3)根据电解池工作原理和氧化还原反应规律书写电解反应式;
(4)根据燃料电池的特点,燃料做负极来书写电解反应式。
(1)由图1可知,CO是反应物,变化量为0.75 mol/L,根据CO(g)+2H2(g)![]() CH3OH(g)反应可知,H2的浓度变化量为1.5 mol/L,所以从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=
CH3OH(g)反应可知,H2的浓度变化量为1.5 mol/L,所以从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=![]() =0.15mol/(L·min),故答案:0.15mol/(L·min);
=0.15mol/(L·min),故答案:0.15mol/(L·min);
(2)由图2可知,反应物为:1molCO(g)和2molH2(g)反应,生成1mol CH3OH(g)放出91kJ热量,所以该反应的热化学方程式:CO(g)+2H2(g)![]() CH3OH(g) △H=-91kJ/mol,故答案:CO(g)+2H2(g)
CH3OH(g) △H=-91kJ/mol,故答案:CO(g)+2H2(g)![]() CH3OH(g) △H=-91kJ/mol;
CH3OH(g) △H=-91kJ/mol;
(3)已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,总反应方程式为:2CO2=2CO+O2,所以阴极反应式为:2CO2+2H2O+4e-=2CO+4OH-,故答案:2CO2+2H2O+4e-=2CO+4OH-;
(4)根据电子移动方向可知,a为负极,充入的是甲醇燃料,失电子发生氧化反应,其电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案:CH3OH+8OH--6e-=CO32-+6H2O。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
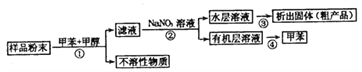
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D



