题目内容
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
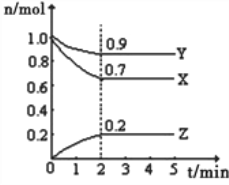
(1)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(2)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。
2HI(g)达到平衡状态的是 _________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
Ⅲ.(1)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4, 铅蓄电池放电时,_______(填物质名称)做负极。放电过程中硫酸浓度由5mol/L 下降到 4mol/L,电解液体积为 2L(反应过程溶液体积变化忽略不计),求放电过程中外电路中转移电子的物质的量为___________mol。
Pb + PbO2 + 2H2SO4, 铅蓄电池放电时,_______(填物质名称)做负极。放电过程中硫酸浓度由5mol/L 下降到 4mol/L,电解液体积为 2L(反应过程溶液体积变化忽略不计),求放电过程中外电路中转移电子的物质的量为___________mol。
(2)有人设计将两根 Pt 丝作电极插入 KOH 溶液中,然后向两极上分别通入乙醇和氧气而 构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:_____________
正极:_____________
【答案】 0.01mol/(L·min) 相等 变大 7:5 ①③④ ⑤ ②④ 铅 2 C2H5OH+16OH--12e-=2CO32-+11H2O O2+4e-+2H2O=4OH-
【解析】Ⅰ.(1)根据化反应速率v=![]() 来计算化学反应速率;
来计算化学反应速率;
(2)混合气体的平均相对分子质量M=![]() ,混合气体密度
,混合气体密度![]() 来判断;
来判断;
(3)根据化学反应中的三段式进行计算;
详解: (1)反应开始至2min,以气体Z表示的平均反应速率v=![]() 0.01mol/(L
0.01mol/(L![]() min),因此,本题正确答案是: 0.01mol/(L
min),因此,本题正确答案是: 0.01mol/(L![]() min);
min);
(2)混合气体密度![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,混合气体的平均相对分子质量M=
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,混合气体的平均相对分子质量M=![]() ,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,因此,本题正确答案是:相等;变大;
,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,因此,本题正确答案是:相等;变大;
(3) 根据图示的内容知道,X和Y是反应物,X、Y、Z的变化量之比是0.3:0.1:0.2=3:1:2,反应的化学方程式为:3X+Y2Z,利用三行式找出有关量,
3X+Y2Z (设Y的变化量是x)
初始量:a b 0
变化量:3x x 2x
平衡量:a-3x b-x 2x
当n(X)=n(Y)=2n(Z)时, a-3x = b-x=4,则a=7x,b=5x,所以原混合气体中a:b=7:5,因此,本题正确答案是: 7:5。
Ⅱ.化学平衡状态时正逆反应速率相等,各物质的浓度、百分含量不变,以此分析。
(1)对于反应2SO2(g)+O2(g)2SO3(g),①混合气体的压强不变,说明气体的物质的量不变,反应达平衡状态,故①正确;②混合气体的密度一直不变,故②错误;③混合气体的总物质的量不变,反应达平衡状态,故③正确;④混合气体的平均相对分子质量,说明气体的物质的量不变,反应达平衡状态,故④正确;⑤混合气体的颜色一直不变,反应达平衡状态,故⑤错误;⑥只要反应发生就有各反应物或生成物的反应速率之比等于化学计量数之比,故⑥错误;故选:①③④;
(2)对于反应I2(g)+H2(g)2HI(g),①混合气体的压强一直不变,故①错误;②混合气体的密度一直不变,故②错误;③混合气体的总物质的量一直不变,故③错误;④混合气体的平均相对分子质量一直不变,故④错误;⑤混合气体的颜色说明碘蒸气的浓度不变,反应达平衡状态,故⑤正确;故选:⑤。
(3)对于反应A(s)+2B(g)![]() C(g)+D(g),①混合气体的压强一直不变,故①错误;②根据
C(g)+D(g),①混合气体的压强一直不变,故①错误;②根据![]() ,混合气体的密度不变,因V不变,说明气体质量一定,即浓度不变,故②正确;③混合气体的总物质的量一直不变,故③错误;④根据M=
,混合气体的密度不变,因V不变,说明气体质量一定,即浓度不变,故②正确;③混合气体的总物质的量一直不变,故③错误;④根据M=![]() ,混合气体的平均相对分子质量不变,因n不变,m则不变,说明各组分气体浓度不变,故④正确;⑤混合气体为无色,故⑤错误;故选②④:。
,混合气体的平均相对分子质量不变,因n不变,m则不变,说明各组分气体浓度不变,故④正确;⑤混合气体为无色,故⑤错误;故选②④:。
Ⅲ.(1)放电时铅失电子而作负极,根据硫酸和转移电子之间的关系式计算;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应.
(1)根据电池反应式知,铅失电子化合价升高而作负极,根据硫酸和转移电子之间的关系式得,转移电子的物质的量=![]() ×2=2mol,
×2=2mol,
故答案为:铅;2;
(3)该燃料电池中,负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C2H5OH+16OH--12e-=2CO32-+11H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+4e
故答案为:C2H5OH+16OH--12e-=2CO32-+11H2O;O2+4e-+2H2O=4OH-。