题目内容
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且毎个能级所含的电子数相间;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出:D基态原子的价层电子排布图__________;F基态原子的外围电子排布式:_________。
(2)下列说法错误的是_________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似。
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F硫酸盐溶液中通入过量的C与A形成的气体X可生成[F (X)4]2+,该离子的结构式为______(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有________。
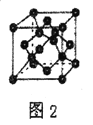
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为_______。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm, F离子的半径b pm,求该晶胞的空间利用率________。

【答案】 ![]() 3d104s2 AD
3d104s2 AD 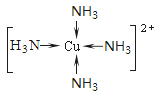 sp2、sp3 8
sp2、sp3 8 ![]()
【解析】B元素含有3个能级1s、2s、2p,且每个能级所含的电子数相同,都是2个电子,则B为C元素;D的原子核外有8个运动状态不同的电子,所以D是O元素;则C是N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,说明E、F是第四周期元素,因为前三周期相邻主族元素的原子序数只差1,E元素的基态原子有4个未成对电子,则E为26号元素Fe,F为29号元素Cu。
(1)根据上述分析,D为O元素,其基态原子的价层电子排布图为![]() ;F为29号元素Cu,其基态原子的外围电子排布式为3d104s2。
;F为29号元素Cu,其基态原子的外围电子排布式为3d104s2。
(2)A.二氧化硅是原子晶体,二氧化碳是分子晶体,所以沸点:SiO2>CO2,故A错误;B.同周期元素随核电荷数增大元素的电负性逐渐增强,则电负性顺序:C<N<O,故B正确;C.N2与CO为等电子体,具有相似的结构,故C正确;D.氢键与熔沸点高低有关,因为O的原子半径小于S的原子半径,所以H2O分子中共价键比H2S强,所以水更稳定,故D错误,故选AD。
(3)F为铜,C为N,N与A形成气体X,则A为H,X为NH3 ,向硫酸铜溶液中通入过量的氨气生成四氨合铜络离子[Cu(NH3)4]2+,该离子的结构式为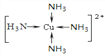 。
。
(4)根据图1可以看出,杂环上的碳原子[C与N(或N)]含有3个σ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化。
(5)根据晶胞结构可知,B原子有4个位于晶胞内部,其余B原子位于顶点、面心,则一个晶胞中所含B原子数为8×1/8+6×1/2+4=8个;
(6)根据上述分析,D与F分别为O、Cu,O与Cu形成离子个数比为1:1的化合物为CuO,CuO晶胞与NaCl类似,其晶胞结构为 ,晶胞中铜离子数目=阳离子数目=8×1/8+6×1/2=4,O2-离子的半径为apm,Cu2+离子的半径bpm,则晶胞中原子总体积=4×(
,晶胞中铜离子数目=阳离子数目=8×1/8+6×1/2=4,O2-离子的半径为apm,Cu2+离子的半径bpm,则晶胞中原子总体积=4×(![]() πa3+
πa3+![]() πb3)pm3,晶胞棱长=2(a+b)pm,晶胞体积=8(a+b)3pm3,所以该晶胞的空间利用率=
πb3)pm3,晶胞棱长=2(a+b)pm,晶胞体积=8(a+b)3pm3,所以该晶胞的空间利用率=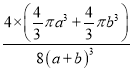 =
=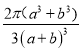 。
。


