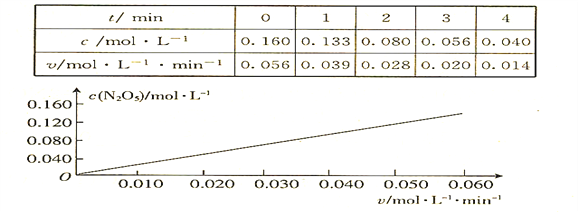
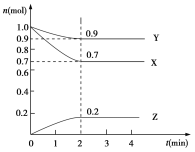
题目内容
【题目】锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备

(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
【答案】 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3 Cu(OH)2 ZnO22-+ 2CO2 + 2H2O = Zn(OH)2↓ + 2HCO3- HCO3->H2CO3>CO32- BaSO4(s) + 4C(s) ![]() BaS(s) + 4CO↑ BaCO3溶解生成的CO32-能被H+结合而减少,促使溶解平衡正向移动,而SO42-不会被H+结合,所以BaSO4不会溶于强酸中 过量的硫酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率
BaS(s) + 4CO↑ BaCO3溶解生成的CO32-能被H+结合而减少,促使溶解平衡正向移动,而SO42-不会被H+结合,所以BaSO4不会溶于强酸中 过量的硫酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率
【解析】I.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22-,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22-转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠。
(1)步骤①中FeCO3与硫酸反应生成二氧化碳,为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤①,故答案为:①;
(2)若步骤②中加入的氧化剂为H2O2,双氧水将亚铁离子氧化,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)根据上述分析,滤渣2中主要成分为Fe(OH)3、Cu(OH)2,故答案为:Fe(OH)3、Cu(OH)2;
(4)步骤④中通二氧化碳将ZnO22-转化为沉淀,反应的离子方程式为ZnO22-+ 2CO2 + 2H2O = Zn(OH)2↓ + 2HCO3-,故答案为:ZnO22-+ 2CO2 + 2H2O = Zn(OH)2↓ + 2HCO3-;
(5)滤液3是碳酸氢钠溶液,电离程度小于水解程度,溶液显碱性,其中含碳粒子的浓度大小顺序为HCO3->H2CO3>CO32-,故答案为:HCO3->H2CO3>CO32-;
(6)煅烧发生反应:BaSO4+4C![]() BaS+4CO↑,BaCO3溶解生成的CO32-能被H+结合而减少,促使溶解平衡正向移动,而SO42-不会被H+结合,所以BaSO4不会溶于强酸中,故答案为:BaSO4(s) + 4C(s)
BaS+4CO↑,BaCO3溶解生成的CO32-能被H+结合而减少,促使溶解平衡正向移动,而SO42-不会被H+结合,所以BaSO4不会溶于强酸中,故答案为:BaSO4(s) + 4C(s) ![]() BaS(s) + 4CO↑ (7). BaCO3溶解生成的CO32-能被H+结合而减少,促使溶解平衡正向移动,而SO42-不会被H+结合,所以BaSO4不会溶于强酸中;
BaS(s) + 4CO↑ (7). BaCO3溶解生成的CO32-能被H+结合而减少,促使溶解平衡正向移动,而SO42-不会被H+结合,所以BaSO4不会溶于强酸中;
(7)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率,故答案为:过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率。