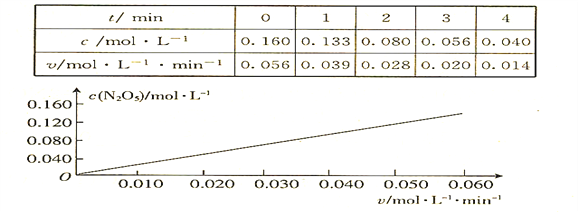
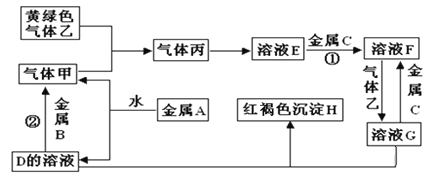
题目内容
【题目】空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
(1)上述3种气体直接排入空气后会引起酸雨的气体有(填化学式).
(2)处理酸雨市场采用NaClO2溶液作为吸收剂,可同时对烟气进行脱硫、脱硝,其中脱硫反应ClO2﹣+2SO32﹣2SO42﹣+Cl﹣ , 该反应的平衡常数K的表达式为;
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,写出电极A的电极方程式 , 当标况下有4.48L被处理时,通过电极B的电子数为 . 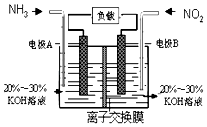
【答案】
(1)SO2、NO2
(2)K= ![]()
(3)2NH3+6e﹣+6OH﹣=N2+6H2O,0.8NA
【解析】解:(1)SO2、NO2和CO中,能和空气中的水蒸气反应的有SO2、NO2,SO2+H2O=H2SO3 H2SO3进一步被氧气氧化为硫酸,3NO2+H2O=2HNO3+NO,硫酸和硝酸融入雨水,形成酸雨,在空气中CO不能与水反应,
故答案为:SO2、NO2;
(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积,所以ClO2﹣+2SO32﹣2SO42﹣+Cl﹣,平衡常数为:K= ![]() ,
,
故答案为:K= ![]() ;
;
(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由﹣3价变为0价,所以NO2发生还原反应、NH3发氧化反应,则A是负极、B是正极,负极电极方程式为2NH3﹣6e﹣+6OH﹣=N2+6H2O,所以电极A极反应式为2NH3﹣6e﹣+6OH﹣═N2+6H2O,当有4.48 L NO2 被处理时,参加反应的NO2物质的量为0.2mol,转移电子物质的量=0.2mol×[4﹣0]=0.8mol,
故答案为:2NH3+6e﹣+6OH﹣=N2+6H2O; 0.8NA.
(1)根据酸雨的形成进行回答;
(2)根据化学平衡常数的定义进行书写;
(3)根据氧化还原反应判断电极发生的反应,然后写出电极方程式,以及计算转移电子的数值.

【题目】电子垃圾中含有大量的废弃塑料和重金属,工业上可以从电子废料(电脑主板和手机废件)中提取大量的金、银和铜,每吨电子废料中能够提取出130公斤铜,0.45公斤黄金和2公斤白银,提取流程如下:

请回答下列问题:
(1)“酸溶”过程中,王水与金反应的化学方程式为________________________。
(2)“萃取”过程中,将混合液分离所需要的主要仪器为____________________,该仪器在使用前必须进行的操作为____________________________。
(3)“还原Ⅰ”制备单质Ag的过程中,发生反应的本质是Zn和AgCl在电解质HCl中形成微电池,该过程的总反应为:2AgCl+Zn=2Ag+ZnCl2,则该电池正极的电极反应式为__________________________。
(4)滤渣的主要成分为Cu2(OH)2CO3,则“沉铜”过程中发生反应的离子方程式为______________________。
(5)滤液为NaCl、Na2CO3和NaHCO3的混合液,若上述三种物质的物质的量浓度相同,则溶液中各离子浓度的大小顺序为______________________。
(6)根据下表中数据,综合分析工业上进行“还原Ⅱ”过程中所选用的还原剂最好为______________。
物质 | 价格(元·吨-1) |
双氧水(含30%H2O2) | 3200 |
绿矾(含99.0%FeSO4·7H2O) | 1800 |
亚硫酸氢钠(含99.5%NaHSO3) | 2850 |
草酸(含99.0%H2C2O4) | 3000 |