题目内容
15.在元素周期表中前四周期的五种主族元素的位置关系如图所示,若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )| D | ||
| A | B | C |
| E |
| A. | 5Z | B. | 5Z+8 | C. | 5Z+10 | D. | 5Z+18 |
分析 由四种元素在周期表中的位置可知,D、B、E分别在周期表的第二、三、四周期,根据同主族元素的原子序数的差值可解答该题.
解答 解:由四种元素在周期表中的位置可知,D、B、E分别在周期表的第二、三、四周期,若B元素的核电荷数为a,
则A的原子序数为a-1,C的原子序数为a+1,D的原子序数为a-8,E的原子序数为a+18,
则五种元素的核电荷总数之和为a+a-1+a+1+a-8+a+18=5a+10,而a=Z,所以五种元素的核电荷数之和为5Z+10,
故选C.
点评 本题考查元素周期表知识,题目难度不大,本题注意把握元素周期表的结构特点,为常考查的知识,注意把握元素周期表的组合规律.

练习册系列答案
相关题目
5.在一定温度下,将气体X和气体Y各0.16mol充入10L 恒容密闭容器中,发生反应:X(g)+Y(g)═2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率ν(Z)=2.0×10-5 mol/(L•min) | |
| B. | 4min时,ν(逆)>ν(正) | |
| C. | 该温度下,此反应的平衡常数K=1.44 | |
| D. | 7min时,反应还未达到平衡状态 |
6.下列实验完毕后,一定能出现白色浑浊现象的是( )
| A. | 浓苯酚溶液中滴加少量稀溴水 | B. | NaAlO2溶液滴入过量苯酚溶液 | ||
| C. | 稀苯酚钠溶液中通入少量CO2 | D. | AgNO3溶液中滴入过量氨水 |
3.下列各组粒子,核外电子总数和质子总数均相同的是( )
| A. | S2-和HS- | B. | H3O+和OH- | C. | Na+和NH${\;}_{4}^{+}$ | D. | K+和Ne |
10.从下列反应物到生成物,反应类型可能属于消去反应的是( )
| A. |  | B. | 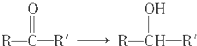 | ||
| C. | R-X→ROH | D. | 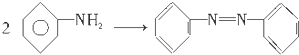 |
20.奥运会中,禁止运动员使用兴奋剂是奥运会的重要举措之一.以下两种兴奋剂的结构分别为:
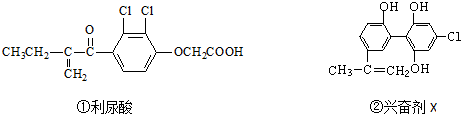
则关于它们的说法中正确的是( )
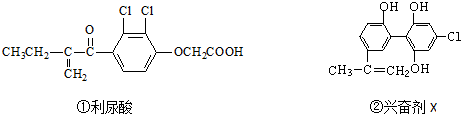
则关于它们的说法中正确的是( )
| A. | 利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰 | |
| B. | 1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 | |
| C. | 两种兴奋剂最多都能和含3molNaOH的溶液反应 | |
| D. | 两种分子中的所有碳原子均不可能共平面 |
7.下列说法或表示方法正确的是( )
| A. | 2A(l)+B(l)=2C(l)△H1 2A (g)+B(g)=2C(l)△H2 则△H1>△H2 | |
| B. | 31g红磷变成31g白磷要吸收能量,说明红磷比白磷更稳定 | |
| C. | 测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 | |
| D. | 在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol |
4.对于铜锌原电池实验后得出的结论和认识中,正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子由锌片流经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
5.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1L 0.1mol/L的醋酸溶液含有0.1nA个H+ | |
| B. | 1molSiO2与足量的焦炭高温下完全反应生成硅,转移4nA个电子 | |
| C. | 标准状况下,11.2L H2O含有共价键的数目为nA | |
| D. | 常温常压下,14 g 由N2与C2H4组成的混合气体含有的原子数目为nA |