题目内容
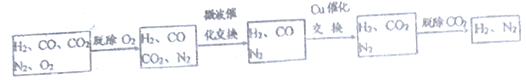
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
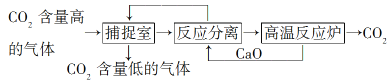
下列有关该方法的叙述中正确的是( )
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发、结晶
④该方法可减少碳排放,“捕捉”到的CO2还可用来制备甲醇等产品
A. ①③ B. ②④ C. ③④ D. ①④
【答案】B
【解析】
试题根据题中信息可知,基本过程中有两个反应:①二氧化碳与氢氧化钠反应,②碳酸钙的高温分解,循环利用的应该有CaO和NaOH 两种物质,捕捉室中反应为二氧化碳与氢氧化钠反应,得到的Na2CO3和CaO在溶液中反应得到NaOH和CaCO3,由此可分析判断。碳酸钙高温分解需要消耗大量的能源,①不正确;氧化钙与氢氧化钠可以循环使用,②正确;碳酸钙不溶于水,所以“反应分离”环节中,分离物质的基本操作是过滤,③不正确;工业上可以用CO2合成甲醇,④正确,答案选B。

练习册系列答案
相关题目