题目内容
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①![]()
②![]()
③![]()
则![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式为________________________________。
的热化学方程式为________________________________。
(2)反应:![]() 。在716K时,容积均为1L的A、B两个密闭容器中,起始时A容器中充入1mol HI、B容器中充入
。在716K时,容积均为1L的A、B两个密闭容器中,起始时A容器中充入1mol HI、B容器中充入![]() 、
、![]() 各0.5mol,气体混合物中碘化氢的物质的量
各0.5mol,气体混合物中碘化氢的物质的量![]() 与反应时间
与反应时间![]() 的关系如下表:
的关系如下表:
| 0 | 20 | 40 | 60 | 80 | 120 |
A容器 | 1 | 0.91 | 0.85 | 0.81 | 0.795 | 0.784 |
B容器 | 0 | 0.6 | 0.73 | 0.77 | 0.78 | 0.784 |
①120min时,可判断A、B容器反应处于平衡状态,理由是________________。716K时,该反应的平衡常数K=_________________(只列计算式即可)。
②上述反应中,正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,其中
,其中![]() 、
、![]() 为速率常数,则
为速率常数,则![]() ________________(以K和
________________(以K和![]() 逆表示)。
逆表示)。

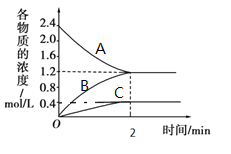
③由A容器中实验数据计算得到![]() 和
和![]() 的关系可用如图表示(
的关系可用如图表示(![]() 为物质的量分数)。当降低到某一温度时,反应重新达到平衡,
为物质的量分数)。当降低到某一温度时,反应重新达到平衡,![]() 和
和![]() 相对应的点可能分别为____、______(填字母)。若向A容器中加入催化剂,则达到平衡时,相对应点的横坐标值______(填“增大”“减小”或“不变”,下同),纵坐标值________。
相对应的点可能分别为____、______(填字母)。若向A容器中加入催化剂,则达到平衡时,相对应点的横坐标值______(填“增大”“减小”或“不变”,下同),纵坐标值________。
【答案】![]() 恒温恒容条件下,A容器从反应物1molHI逐渐到达平衡,B容器从生成物H2、I2(g)各0.5mol逐渐到达平衡,在120min时n(HI)都为0.784mol,恰好到达平衡状态
恒温恒容条件下,A容器从反应物1molHI逐渐到达平衡,B容器从生成物H2、I2(g)各0.5mol逐渐到达平衡,在120min时n(HI)都为0.784mol,恰好到达平衡状态 ![]() K·k逆 D G 不变 增大
K·k逆 D G 不变 增大
【解析】
(1)I2(g)与O2反应生成I2O5(g)的方程式为![]() ;
;
已知:①![]()
②![]()
③![]()
反应①×5-2×(②+③)可得目标反应方程式,根据盖斯定律可知![]() △H=(-1200kJmol-1)×5-(-2017kJmol-1+36kJmol-1)×2=-2038kJmol-1;
△H=(-1200kJmol-1)×5-(-2017kJmol-1+36kJmol-1)×2=-2038kJmol-1;
(2)①恒温恒容条件下,A容器从反应物1mol HI逐渐到达平衡,B容器从生成物H2、I2(g)各0.5mol逐渐到达平衡,在120min时n(HI)都为0.784mol,恰好到达平衡状态;容器体积为1L,列三段式有:
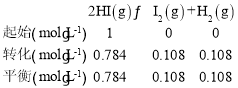
根据平衡常数的定义可知该反应的平衡常数K=![]() ;
;
②平衡时v正=v逆,即![]() =
=![]() ,
,![]() ,所以k正=K·k逆;
,所以k正=K·k逆;
③降低稳度,正逆反应速率均减慢,正反应焓变大于零为吸热反应,降低稳定平衡逆向移动,HI的物质的量分数变大,H2的物质的量分数变小,所以![]() 对应的点可能为D,
对应的点可能为D,![]() 对应的点可能为G;加入催化剂反应速率加快,但不影响平衡移动,所以横坐标不变,纵坐标增大。
对应的点可能为G;加入催化剂反应速率加快,但不影响平衡移动,所以横坐标不变,纵坐标增大。

 阅读快车系列答案
阅读快车系列答案