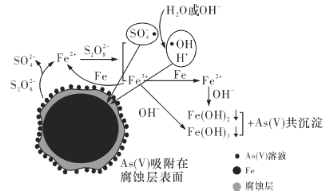
题目内容
【题目】下列关于甲、乙、丙、丁四个图像的说法中,正确的是( )
A.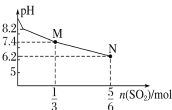 表示用1 L 1 mol·L-1 Na2SO3溶液吸收SO2时溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO32-)>c(HSO3)
表示用1 L 1 mol·L-1 Na2SO3溶液吸收SO2时溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO32-)>c(HSO3)
B.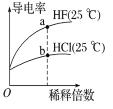 a点Kw的数值比b点Kw的数值大
a点Kw的数值比b点Kw的数值大
C.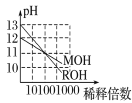 表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
D.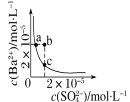 表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
【答案】C
【解析】
A.M点pH=7.4,n(SO2)=![]() mol,根据方程式Na2SO3+SO2+H2O=2NaHSO3可知得到的溶液中有
mol,根据方程式Na2SO3+SO2+H2O=2NaHSO3可知得到的溶液中有![]() molNaHSO3和
molNaHSO3和![]() molNa2SO3,亚硫酸根离子水解显碱性,亚硫酸氢根离子电离显酸性,溶液显碱性,亚硫酸根离子水解程度大,则c(SO32-)<c(HSO3-),故A错误;
molNa2SO3,亚硫酸根离子水解显碱性,亚硫酸氢根离子电离显酸性,溶液显碱性,亚硫酸根离子水解程度大,则c(SO32-)<c(HSO3-),故A错误;
B.Kw只与温度有关,两点的温度相同,则Kw相同,故B错误;
C.稀释相同倍数时ROH溶液的pH变化比MOH溶液的pH变化大,说明ROH的碱性比MOH的碱性强,故C正确;
D.温度不变溶度积不变,则加入Na2SO4后点的变化仍位于该曲线上,故D错误;
故答案为C。

【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①![]()
②![]()
③![]()
则![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式为________________________________。
的热化学方程式为________________________________。
(2)反应:![]() 。在716K时,容积均为1L的A、B两个密闭容器中,起始时A容器中充入1mol HI、B容器中充入
。在716K时,容积均为1L的A、B两个密闭容器中,起始时A容器中充入1mol HI、B容器中充入![]() 、
、![]() 各0.5mol,气体混合物中碘化氢的物质的量
各0.5mol,气体混合物中碘化氢的物质的量![]() 与反应时间
与反应时间![]() 的关系如下表:
的关系如下表:
| 0 | 20 | 40 | 60 | 80 | 120 |
A容器 | 1 | 0.91 | 0.85 | 0.81 | 0.795 | 0.784 |
B容器 | 0 | 0.6 | 0.73 | 0.77 | 0.78 | 0.784 |
①120min时,可判断A、B容器反应处于平衡状态,理由是________________。716K时,该反应的平衡常数K=_________________(只列计算式即可)。
②上述反应中,正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,其中
,其中![]() 、
、![]() 为速率常数,则
为速率常数,则![]() ________________(以K和
________________(以K和![]() 逆表示)。
逆表示)。
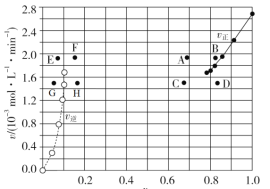
③由A容器中实验数据计算得到![]() 和
和![]() 的关系可用如图表示(
的关系可用如图表示(![]() 为物质的量分数)。当降低到某一温度时,反应重新达到平衡,
为物质的量分数)。当降低到某一温度时,反应重新达到平衡,![]() 和
和![]() 相对应的点可能分别为____、______(填字母)。若向A容器中加入催化剂,则达到平衡时,相对应点的横坐标值______(填“增大”“减小”或“不变”,下同),纵坐标值________。
相对应的点可能分别为____、______(填字母)。若向A容器中加入催化剂,则达到平衡时,相对应点的横坐标值______(填“增大”“减小”或“不变”,下同),纵坐标值________。
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
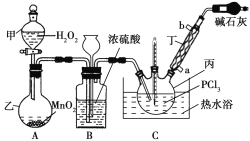
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。