题目内容
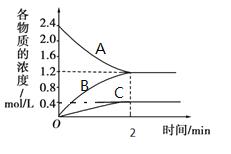
【题目】某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为__。
(2)从开始至2min,B的平均反应速率为__。
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号)__。
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3nmolA,同时消耗nmol的B
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是___。
A.加催化剂
B.降低温度
C.体积不变,充入A
D.体积不变,从容器中分离出A
(5)改变影响平衡的一个条件,5分钟后又建立了新平衡,发现C占平衡混合气的体积分数为![]() ,则反应物A的分解率为___。
,则反应物A的分解率为___。
【答案】3A![]() 3B+C 0.6mol/(Lmin) E BD 37.5%
3B+C 0.6mol/(Lmin) E BD 37.5%
【解析】
(1)根据图示可知反应物为A,生成物为B和C,反应物A的浓度最终没有减少到0,则该反应为可逆反应,各物质浓度的变化量分别为:c(A)=(2.4-1.2)mol/L=1.2mol/L,c(C)=0.4mol/L,c(B)=1.2mol/L,所以A、B、C三者计量数之比为1.2:1.2:0.4=3:3:1,所以该反应的化学方程式3A![]() 3B+ C,故答案为:3A
3B+ C,故答案为:3A![]() 3B+C;
3B+C;
(2)c(B)=1.2 mol/L,从开始至2min,B的平均反应速率=![]() =0.6mol/(L min),故答案为:0.6mol/(L min);
=0.6mol/(L min),故答案为:0.6mol/(L min);
(3)A.A、B、C的物质的量之比为3:1:3 的状态,正逆反应速率不一定相等,仅仅是反应的一种特殊情况,不能判定反应已达到化学平衡状态,A不满足题意;
B.相同时间内消耗3molA,同时生成3molC,反应速率同向,不能判定反应已达到化学平衡状态,B不满足题意;
C.相同时间内消耗3nmolA和生成3nmolB等效,消耗nmolB,说明B的正反应速率大于逆反应速率,反应未达到平衡状态,C不满足题意;
D.A、B、C均为气态,反应前后气体的总质量不变,为定值,所以气体总质量不随时间的变化而变化不能判定反应已达到化学平衡状态,D不满足题意;
E.B的体积分数不再发生变化,说明B的量不再变化,已达到平衡状态,,E满足题意;
故答案为:E;
(4)A.加催化剂,反应速率加快,A不满足题意;
B.降低温度,反应速率减慢,B满足题意;
C.体积不变,充入A,反应物浓度增大,反应速率加快,C不满足题意;
D.体积不变,从容器中分离出A,A的浓度减小,反应速率减慢,D满足题意;
故答案为:BD;
(5)设A的起始浓度为a,反应开始到建立新平衡转化浓度为3xmol/L,则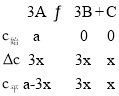 ,
,![]() =
=![]() ,解得x=
,解得x=![]() a,所以A的分解率=
a,所以A的分解率=![]() ×100%=37.5%,故答案为:37.5。
×100%=37.5%,故答案为:37.5。

【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:![]()
![]()
![]() +H2(g)
+H2(g)
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应生成1mol氢气的热效应___(填吸放多少kJ)
(2)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图。
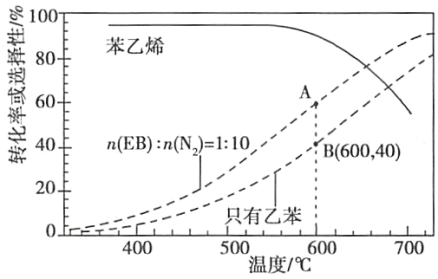
①A、B两点对应的正反应速率较大的是___。
②控制反应温度为600℃的理由是___。
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①![]()
②![]()
③![]()
则![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式为________________________________。
的热化学方程式为________________________________。
(2)反应:![]() 。在716K时,容积均为1L的A、B两个密闭容器中,起始时A容器中充入1mol HI、B容器中充入
。在716K时,容积均为1L的A、B两个密闭容器中,起始时A容器中充入1mol HI、B容器中充入![]() 、
、![]() 各0.5mol,气体混合物中碘化氢的物质的量
各0.5mol,气体混合物中碘化氢的物质的量![]() 与反应时间
与反应时间![]() 的关系如下表:
的关系如下表:
| 0 | 20 | 40 | 60 | 80 | 120 |
A容器 | 1 | 0.91 | 0.85 | 0.81 | 0.795 | 0.784 |
B容器 | 0 | 0.6 | 0.73 | 0.77 | 0.78 | 0.784 |
①120min时,可判断A、B容器反应处于平衡状态,理由是________________。716K时,该反应的平衡常数K=_________________(只列计算式即可)。
②上述反应中,正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,其中
,其中![]() 、
、![]() 为速率常数,则
为速率常数,则![]() ________________(以K和
________________(以K和![]() 逆表示)。
逆表示)。
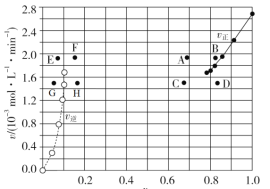
③由A容器中实验数据计算得到![]() 和
和![]() 的关系可用如图表示(
的关系可用如图表示(![]() 为物质的量分数)。当降低到某一温度时,反应重新达到平衡,
为物质的量分数)。当降低到某一温度时,反应重新达到平衡,![]() 和
和![]() 相对应的点可能分别为____、______(填字母)。若向A容器中加入催化剂,则达到平衡时,相对应点的横坐标值______(填“增大”“减小”或“不变”,下同),纵坐标值________。
相对应的点可能分别为____、______(填字母)。若向A容器中加入催化剂,则达到平衡时,相对应点的横坐标值______(填“增大”“减小”或“不变”,下同),纵坐标值________。