题目内容
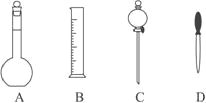
【题目】(1)实验室配制 500mL 0.2mol/L 的 NaOH溶液,在下图所示仪器中,配制上述溶液肯定不需要的是____(填序号),除图中已有仪器外, 配制上述溶液还需要的玻璃仪器是_________。
具体过程如下:
①计算需要称量 NaOH 固体的质量_____;
②用少量蒸馏水洗涤烧杯内壁 2~3 次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
③用托盘天平称量 NaOH 固体;
④将 NaOH 溶液沿玻璃棒注入_____中;
⑤将称好的 NaOH 固体放入烧杯中,用适量蒸馏水溶解,并____________;
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将蒸馏水注入容量瓶,液面离刻度线下_____cm 时,改用_______滴加蒸馏水至液面于刻度线相切;
试回答下列问题:
(2)上述过程的正确顺序为___________(填步骤序号);
(3)经精确测量,最后所得溶液物质的量浓度为 0.192mol/L,原因可能是____________。
A、使用滤纸称量 NaOH 固体; B、未冷却直接转移至容量瓶,立即配好;
C、容量瓶中原来有少量蒸馏水; D、称量时所用的砝码生锈;
E、溶解 NaOH 后的烧杯未经多次洗涤; F、定容时俯视刻度。
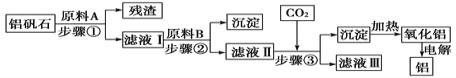
【答案】C 玻璃棒、烧杯 4g 500mL容量瓶 冷却到室温 1~2 胶头滴管 ①③⑤④②⑦⑥ AE
【解析】
根据配制一定物质的量浓度溶液的操作、误差分析及注意事项分析解答。
(1)配制一定物质的量浓度溶液需要烧杯、玻璃棒、胶头滴管、500mL容量瓶,托盘天平或量筒,不需要分液漏斗;
故答案为:C ;玻璃棒、烧杯;
①配制 500mL 0.2mol/L 的 NaOH溶液,NaOH的物质的量为:n(NaOH)=0.2mol/L×0.5L=0.1mol,所以需要m(NaOH)=n×M=0.1mol×40g/mol=4g;④操作是转移,需要用玻璃棒引流,转移到500mL容量瓶中,⑤操作是将NaOH固体溶解,冷却后转移,⑦操作是定容,将蒸馏水注入容量瓶,液面离刻度线下1-2cm处时,改用胶头滴管滴加蒸馏水至液面于刻度线相切;
故答案为:4g ;500mL容量瓶 ;冷却到室温;1~2 ;胶头滴管;
(2) 配制一定物质的量浓度溶液的操作流程是称量——溶解——冷却——转移——洗涤——定容——摇匀——装瓶贴标签;
故答案为:①③⑤④②⑦⑥;
(3) 最后所得溶液物质的量浓度为 0.192mol/L比配制浓度偏小,
A.称量氢氧化钠固体时,使用滤纸称量 NaOH 固体,使得固体药品沾在滤纸上,溶质的物质的量减小,导致配制溶液的浓度偏小,故A正确;
B. 若未冷却直接转移至容量瓶,立即配好,溶液体积偏小,导致溶液浓度偏大,故B错误;
C. 容量瓶中原来有少量蒸馏水对配制溶液的浓度无影响,故C错误;
D. 称量时所用的砝码生锈,导致砝码实际质量增加,所以会导致固体溶质比砝码标的质量多,即会导致溶液浓度增大,故C错误;
E. 溶解 NaOH 后,会有少量NaOH沾在烧杯壁和玻璃棒上,使溶质质量减小,导致溶液浓度偏小,故E正确;
故答案为:AE。

【题目】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+OH─(aq)=H2O(l) △H=-57.3kJ ·mol-1。按照图1所示装置进行实验。
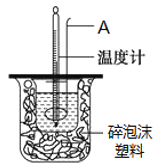
(1)仪器A的名称是________。
(2)碎泡沫塑料的作用是________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L-1 CH3COOH溶液、50mL 0.55 mol·L-1 NaOH溶液进行实验,测得的中和热△H________-57. 3 kJ ·mol-1(填“>”“=”或“<”),原因是 ________。
Ⅱ.中和滴定
(1)用_______量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为________ (保留两位有效数字)。滴定达到终点的标志是________。
(2)若某次滴定结束时,滴定管液面如图2所示,则终点读数为________mL。