题目内容
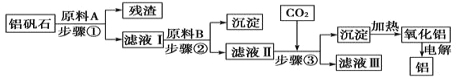
【题目】铝矾石(主要成分是Al2O3,还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下:
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,正确的是________。
A.铝矾石中含有两种类型氧化物
B.铝矾石与河沙含有完全相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中涉及置换反应
(2)加入原料A时发生反应的离子方程式有_____________。
(3)滤液Ⅱ中所含溶质有__________;步骤③反应的离子方程式为___________。
(4)若步骤③中用氨气代替CO2,步骤③生成沉淀的离子方程式为______________。
【答案】C Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O NaOH、NaAlO2 OH-+CO2=HCO3-、CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- Al3++3NH3·H2O=Al(OH)3↓+NH4+
【解析】
氢氧化铝受热分解生成氧化铝,则步骤③中生成的沉淀是氢氧化铝,因此滤液Ⅱ中含有偏铝酸盐,则原料B是强碱,因此滤液Ⅰ中含有铝盐和铁盐,则原料A应该是酸,所以残渣是二氧化硅,结合问题分析解答。
(1)A、铝矾石中含有的SiO2是非金属氧化物,氧化铁是金属氧化物,氧化铝是两性氧化物,因此含有三种类型的氧化物,故A错误;
B、河沙的主要成分为SiO2,因此铝矾石与河沙含有的成分不完全相同,故B错误;
C、电解法炼铝,必定消耗电能,故C正确;
D、步骤①是酸溶解氧化铁和氧化铝,步骤②是碱沉淀铁离子以及把铝离子转化为偏铝酸根离子,步骤③是二氧化碳把偏铝酸根离子转化为氢氧化铝沉淀,氢氧化铝分解以及氧化铝电解均是分解反应,所以铝矾石炼铝的过程中涉及复分解反应、分解反应等,不涉及置换反应,故D错误。
答案选C。
(2)原料A溶解矿石,可利用强酸,分离出不溶物SiO2,反应的离子方程式为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(3)步骤②中可加入强碱例如氢氧化钠,沉淀出Fe3+,使Al3+转化为偏铝酸根离子留在溶液里,所以滤液Ⅱ中所含溶质为NaOH、NaAlO2。通入CO2发生的反应为:OH-+CO2=HCO3-、CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(4)若步骤③中用氨气代替CO2,则滤液Ⅱ中含有铝离子,则步骤③生成沉淀的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+NH4+。

 中考解读考点精练系列答案
中考解读考点精练系列答案