题目内容
【题目】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
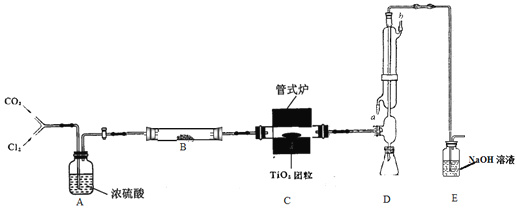
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+OH─(aq)=H2O(l) △H=-57.3kJ ·mol-1。按照图1所示装置进行实验。
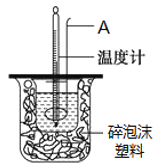
(1)仪器A的名称是________。
(2)碎泡沫塑料的作用是________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L-1 CH3COOH溶液、50mL 0.55 mol·L-1 NaOH溶液进行实验,测得的中和热△H________-57. 3 kJ ·mol-1(填“>”“=”或“<”),原因是 ________。
Ⅱ.中和滴定
(1)用_______量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为________ (保留两位有效数字)。滴定达到终点的标志是________。
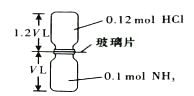
(2)若某次滴定结束时,滴定管液面如图2所示,则终点读数为________mL。

【答案】 环形玻璃搅拌棒 保温、隔热,减少实验过程中热量损失 > CH3COOH是弱酸,在反应过程中会继续电离吸收热量,使放出的热量减少,△H>-57.3 kJ/mol 酸式滴定管 0.23mol·L—1 滴入最后一滴氢氧化钠溶液,溶液由无色恰好变成红色,半分钟内不褪色 23.10
【解析】试题分析:Ⅰ.(1)根据装置图分析仪器A的名称。(2)碎泡沫塑料具有隔热的作用;(3)CH3COOH是弱酸,弱电解质电离吸热;Ⅱ.(1)量取盐酸的体积是20.00mL,精度为0.01mL,所以用酸式滴定管量取;第一次实验数值偏离正常的误差范围,所以根据第二次、第三次实验数值计算平均消耗氢氧化钠溶液的体积是23.01mL;根据![]() 计算盐酸浓度;(2)根据滴定管液面图2所示,凹液面最低处所示的刻度为终点读数;
计算盐酸浓度;(2)根据滴定管液面图2所示,凹液面最低处所示的刻度为终点读数;
解析:Ⅰ.(1)根据装置图仪器A的名称是环形玻璃搅拌棒。(2)碎泡沫塑料的作用是保温、隔热,减少实验过程中热量损失; (3)CH3COOH是弱酸,在反应过程中会继续电离吸收热量,使放出的热量减少,△H>-57.3 kJ/mol;Ⅱ.(1)量取盐酸的体积是20.00mL,精度为0.01mL,所以用酸式滴定管量取;第一次实验数值偏离正常的误差范围,所以根据第二次、第三次实验数值计算平均消耗氢氧化钠溶液的体积是23.01mL;根据![]() ,
, ![]() ,所以盐酸的浓度约为0.23mol·L—1;滴定达到终点的标志是滴入最后一滴氢氧化钠溶液,溶液由无色恰好变成红色,半分钟内不褪色;(2)根据滴定管液面图2所示,凹液面最低处所示的刻度为23.10mL。
,所以盐酸的浓度约为0.23mol·L—1;滴定达到终点的标志是滴入最后一滴氢氧化钠溶液,溶液由无色恰好变成红色,半分钟内不褪色;(2)根据滴定管液面图2所示,凹液面最低处所示的刻度为23.10mL。

【题目】Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
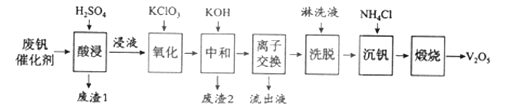
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________
(2)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________,___________。