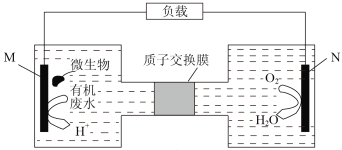
题目内容
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为____________,被选作相对原子质量标准的核素是 ______(填核素符号)
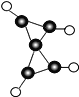
(2)由A、B、W三种元素组成的18电子微粒的电子式为___________________
(3)A、B、W、D、E五种元素的原子半径由小到大的顺序为__________ ( 填元素符号)
(4)元素D的单质在一定条件下,能与A单质化合生成DA,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气体的体积是___________________(标准状况下)
(5)若要比较D比E的金属性强弱,下列实验方法可行的是 (____________)
A.将单质D置于E的盐溶液中,若D不能置换出单质E,说明D的金属性弱
B.比较D和E的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强
【答案】 第三周期 IIIA族 12C 或 612C  H< O< C< Al< Na 56L C
H< O< C< Al< Na 56L C
【解析】A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素。
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,,国际上选作相对原子质量标准的核素为12C,故答案为:第三周期第ⅢA族;12C;
(2)由H、C、O三种元素组成的18电子微粒,该微粒中只能含有1个C原子、1个O原子,故含有H原子数目=18-6-8=4,故该微粒结构简式为CH3OH,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)同一周期,从左到右,原子半径逐渐减小,同一主族,从上到下,原子半径逐渐增大,A、B、W、D、E五种元素的原子半径由小到大的顺序为H< O< C< Al< Na,故答案为:H< O< C< Al< Na;
(4)NaH能与水反应放氢气,将1mol NaH和1molAl单质混合加入足量的水,首先发生反应NaH+H2O=NaOH+H2↑,生成1mol氢气,铝与反应生成的氢氧化钠继续反应2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑,有放出1.5mol氢气,共生成2.5mol氢气,标准状况下的体积为56L,故答案为:56L;
(5)A.将钠置于盐溶液中,首先发生钠与水的反应,不能比较钠与铝的金属性强弱,错误; B.最高价氧化物对应水化物的水溶性,是物理性质,与元素的金属性强弱无关,不能比较钠与铝的金属性强弱,错误;C.金属性越强,与酸反应的速率越快,将钠和铝的单质分别投入到同浓度的盐酸中,观察到钠反应更剧烈,说明钠的金属性强,正确;故选C。