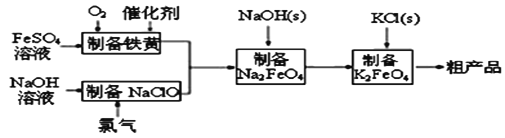
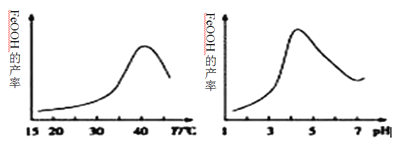
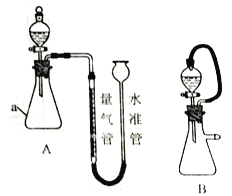
��Ŀ����
����Ŀ�������������ʵ���Ҫ���Ԫ��֮һ���������������������������ء�
��1����ԭ�����������Ų�ʽΪ��_________��������![]() ������___���˶�״̬��ͬ�ĵ��ӣ�N4���ӵĿռ�ṹ��ͼ��
������___���˶�״̬��ͬ�ĵ��ӣ�N4���ӵĿռ�ṹ��ͼ��![]() ������һ��_____���ӡ������������������Ǽ�������
������һ��_____���ӡ������������������Ǽ�������
��2���������˹��̵��IJ������������ˮ��![]() ��������NH3 �� H2O�������ʵ��֤��NH3 �� H2O������_______________________________��
��������NH3 �� H2O�������ʵ��֤��NH3 �� H2O������_______________________________��
��3����100mL 0.1mol/L��������ͨ��0.02mol������������պ�����Һ�ʼ��ԡ������Һ��NH3 �� H2O��![]() ��
��![]() �����������ʵ���Ũ�ȴ�С��ϵΪ____________��
�����������ʵ���Ũ�ȴ�С��ϵΪ____________��
��4����ο��������ʣ�ʵ���Ҽ�������е�![]() ʱ����ȡ���������Ʒ���Թ��У�����ǿ��Ũ��Һ�����ȣ���������������ʹ________________________________��˵����
ʱ����ȡ���������Ʒ���Թ��У�����ǿ��Ũ��Һ�����ȣ���������������ʹ________________________________��˵����![]() ��
��
��5��NaN3����������������ȫ���ң�����������ײ��ʱ��NaN3��Ѹ�ٷֽ����Na��N2����д���÷�Ӧ�Ļ�ѧ����ʽ_______________________��ÿ����3mol N2ʱ��ת�Ƶ���_____mol��
���𰸡� 2s22p3 10 �Ǽ��� ȡpH=10�İ�ˮ��Һ��ϡ��10������pH>9��˵��NH3��H2O��������NH4Cl��ҺpH<7��˵��NH3��H2O����� c��NH4+��> c��Cl-��> c��NH3��H2O�� ʪ��ĺ�ɫʯ����ֽ���� 2NaN3 ��2Na+3N2�� 2
��������(1)����7��Ԫ�أ�ԭ�����������Ų�ʽΪ��������![]() ������10�����ӣ�ÿ�ֵ��ӵ��˶�״̬������ͬ����10���˶�״̬��ͬ�ĵ��ӣ�N4������������ṹ����һ�ַǼ��Է��ӣ��ʴ�Ϊ��2s22p3�� 10���Ǽ��ԣ�
������10�����ӣ�ÿ�ֵ��ӵ��˶�״̬������ͬ����10���˶�״̬��ͬ�ĵ��ӣ�N4������������ṹ����һ�ַǼ��Է��ӣ��ʴ�Ϊ��2s22p3�� 10���Ǽ��ԣ�
(2)Ҫ���ʵ��֤��NH3 �� H2O�����ֻ��ҪȡpH=10�İ�ˮ��Һ��ϡ��10������pH>9��˵��NH3��H2O������ʴ�Ϊ��ȡpH=10�İ�ˮ��Һ��ϡ��10������pH>9��˵��NH3��H2O��������NH4Cl��ҺpH<7��˵��NH3��H2O�����
(3)100mL 0.1mol/L�������к���0.01mol�Ȼ��⣬ͨ��0.02mol������������պ���Һ�к��е����ʵ������Ȼ�狀�NH3��H2O����Һ�ʼ��ԣ���NH3��H2O�ĵ���Ϊ��������Һ��NH3 �� H2O��![]() ��
��![]() �����������ʵ���Ũ�ȴ�С��ϵΪc(NH4+)> c(Cl-)> c(NH3��H2O)���ʴ�Ϊ��c(NH4+)> c(Cl-)> c(NH3��H2O)��
�����������ʵ���Ũ�ȴ�С��ϵΪc(NH4+)> c(Cl-)> c(NH3��H2O)���ʴ�Ϊ��c(NH4+)> c(Cl-)> c(NH3��H2O)��
(4)ʵ���Ҽ�������е�![]() ʱ����ȡ���������Ʒ���Թ��У�����ǿ��Ũ��Һ�����ȣ���������������ʹʪ��ĺ�ɫʯ����ֽ������˵����
ʱ����ȡ���������Ʒ���Թ��У�����ǿ��Ũ��Һ�����ȣ���������������ʹʪ��ĺ�ɫʯ����ֽ������˵����![]() ���ʴ�Ϊ��ʪ��ĺ�ɫʯ����ֽ������
���ʴ�Ϊ��ʪ��ĺ�ɫʯ����ֽ������
(5)NaN3����������������ȫ���ң�����������ײ��ʱ��NaN3��Ѹ�ٷֽ����Na��N2����Ӧ�Ļ�ѧ����ʽΪ2NaN3 =2Na+3N2�������ݷ�Ӧ����ʽ��ÿ����3mol N2ʱ��ת�Ƶ���2mol���ʴ�Ϊ��2NaN3 ��2Na+3N2�� ��2��

����Ŀ����Ȼ���У�����Ԫ�ش���Ի���̬���ڣ�ͨ������ұ���õ��������ʡ�
������ҵ������Na��Ca��Mg���õ�������ڵ��Ȼ�������������ý����ƺ��ۻ���KCl��һ���������·�Ӧ��ȡ��
KCl + Na![]() NaCl + K + Q ��Q��0��
NaCl + K + Q ��Q��0��
�й��������±���
�۵��� | �е��� | �ܶ� (g/cm3) | |
Na | 97.8 | 882.9 | 0.97 |
K | 63.7 | 774 | 0.86 |
NaCl | 801 | 1413 | 2.165 |
KCl | 770 | 1500 | 1.984 |
��1������ƽ���ƶ����۷�����Ϊʲô���ø÷�Ӧ�Ʊ������ء�
_______________________________________��
��2���ڳ�ѹ�½�����תΪ��̬�ӷ�Ӧ������з��������¶�ԼΪ_____��������Ӧ������¶�Ӧ����_____����
��3������ȡ�����صĹ����У�Ϊ�����ԭ�ϵ�ת���ʿɲ�ȡ�Ĵ�ʩ��__________������д���㣩
��4������ڵ�������Ȼ��أ��˷������ŵ���_____________________��
��5����ѹ�£�����Ӧ�¶����ߵ�900��ʱ���÷�Ӧ��ƽ�ⳣ���ɱ�ʾΪ![]() ________��
________��
����Ŀ��̼�͵��Ļ����������������й㷺���ڡ��ش��������⣺
��1�����Ȱ���NH2Cl���ĵ���ʽΪ_______��
�ڹ�ҵ�Ͽ�����Cl2��NH3��Ӧ�Ʊ��Ȱ����÷�Ӧ�Ļ�ѧ����ʽΪ_______��
��2��һ�������£���ͬ���ʵ�����CO2�벻ͬ�����1.0 mol��L-1 NaOH��Һ��ַ�Ӧ�ų����������±���ʾ��
��Ӧ��� | CO2�����ʵ���/mol | NaOH��Һ�����/L | �ų�������/kJ |
1 | 0.5 | 0.75 | x |
2 | 1.0 | 2.00 | y |
��������CO2��NaOH��Һ��Ӧ����NaHCO3���Ȼ�ѧ��Ӧ����ʽΪ__________��
��3���ý�̿��ԭNO�ķ�ӦΪ��2NO(g) + C(s) ![]() N2(g) + CO2(g)�����ݻ���Ϊ1 L�ļס��ҡ����������£���Ӧ�¶ȷֱ�Ϊ400 �桢T �桢400 �棩�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
N2(g) + CO2(g)�����ݻ���Ϊ1 L�ļס��ҡ����������£���Ӧ�¶ȷֱ�Ϊ400 �桢T �桢400 �棩�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)����������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)����������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)����������/ml | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
�ټ������У�0~40 min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NO)=_________��
�ڸ÷�Ӧ�Ħ�H___0 (���������)��
�۱������ﵽƽ��ʱ��NO��ת����Ϊ___________��
��4�������£���NH4HCO3��Һ�У�c(NH4+)________c(HCO3-) (�����������������)����ӦNH4+��HCO3-��H2O ![]() NH3��H2O��H2CO3��ƽ�ⳣ��K��__________��(��֪�����£�NH3��H2O�ĵ���ƽ�ⳣ��Kb �� 2��10��5��H2CO3�ĵ���ƽ�ⳣ��Ka1 �� 4��10��7��Ka2 �� 4��10��11)
NH3��H2O��H2CO3��ƽ�ⳣ��K��__________��(��֪�����£�NH3��H2O�ĵ���ƽ�ⳣ��Kb �� 2��10��5��H2CO3�ĵ���ƽ�ⳣ��Ka1 �� 4��10��7��Ka2 �� 4��10��11)