题目内容
【题目】溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:

步骤1:在a中加入20mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中充分反应.将b 中的液溴慢慢加入到a中,而不能快速加入的原因是_______________。继续滴加液溴至完全加入。装置d的作用是___________________。
步骤2:向a中加入15mL水,然后_____________(填操作名称)除去未反应的铁屑。
步骤3:再依次用10mL水、8mL10%的Na0H溶液、10mL水洗涤,分液得粗溴苯。Na0H溶液洗涤的作用是________________。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙.静置、过滤即得粗产品。加入氯化钙的目的是_______。
已知溴、苯、溴苯的有关物理性质如下表:
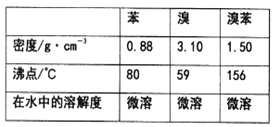
(1)实验装置中,仪器c的名称为______________,作用是冷凝回流.回流的主要物质有_______________(填化学式)。
(2)步骤4得到的粗产品中还含有杂质苯,则要进一步提纯粗产品,还必须进行的实验操作名称是_______________。
(3)在该实验中,a的容积最适合的是_________(填入正确选项前的字母)。
A.500mL B. 250 mL C.10O mL D.50 mL
(4)若步骤4的粗产品经进一步精制得到5.7mL的溴苯,则该实验中溴苯的产率是___________。
【答案】 防止反应放出的热使C6H6、Br2挥发而影响产率 吸收HBr,防污染,防倒吸 过滤 除去HBr和未反应的Br2 干燥 球形冷凝管 C6H6、Br2 蒸馏 C 70%
【解析】步骤1:由于苯与液溴的反应为放热反应,若加入液溴速度过快,反应会放出较多的热量,由于苯和溴的沸点较低,导致苯和溴会挥发出来,影响了溴苯的产率,所以不能快速加入。继续滴加液溴至完全加入。生成的溴化氢需要用氢氧化钠吸收,又因为溴化氢极易溶于水,则装置d的作用是吸收HBr,防污染,防倒吸。
步骤2:向a中加入15mL水,铁不溶于水,则后续操作是过滤除去未反应的铁屑。
步骤3:粗溴苯中含有溴和溴化氢,因此Na0H溶液洗涤的作用是 除去HBr和未反应的Br2。
步骤4:氯化钙易吸水,则加入氯化钙的目的是干燥。
(1)根据仪器构造可判断仪器c的名称为球形冷凝管;苯的沸点为80℃,溴的沸点为59℃,二者沸点较低,容易挥发出来,所以回流的主要物质有C6H6、Br2;(2)利用沸点不同,苯的沸点小,被蒸馏出,溴苯留在母液中,所以采取蒸馏的方法分离溴苯与苯;(3)在a中加入20mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中充分反应,这说明液体的体积在25mL左右,所以a的容积最适合的是100mL,答案选C;(4)5.7mL的溴苯的质量为:1.50gcm-3×5.7mL=8.55g,溴苯的物质的量为:8.55g÷157g/mol=0.054mol;
20mL苯的质量为:0.88g/mL×20mL=1.76g,物质的量为:1.76g÷78g/mol=0.23mol,4.0mL液溴的物质的量为:3.1×4.0/160mol=0.0775mol,显然苯过量,该实验中溴苯的产率为:0.054mol/0.0775mol×100%=70%。

【题目】钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为______________,其原子核外未成对电子有_____个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为____堆积(填堆积方式),其中钛原子的配位数为________。

(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为______晶体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因_________________________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为___________。
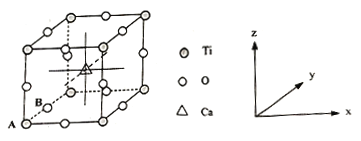
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________。


