题目内容
【题目】短周期元素X的气态氢化物的化学式为H2X,则X属于( )
A. IV A族 B. V A族 C. VI A族 D. VII A族
【答案】C
【解析】X的气态氢化物的化学式为H2X,说明X的最低价是-2,最高价是+6,所以X属于VI A族元素,故C正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g) ![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如右表所示:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH____(填“>”“<”或“=”)0.
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=____、CO的平衡转化率=____.
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时,某时刻CO2和CO的物质的量浓度分别为0.2mol·L-1和0.1mol·L-1,则此时反应是否达到平衡_____(填“是”或“否”),V(正)_____V(逆)(填“>”“<”或“=”)
【题目】下列叙述正确的是
A. 摩尔是表示物质微粒数的单位
B. H2SO4的摩尔质量是98g
C. 标准状况下,1mol任何物质的体积都约为22.4L
D. 一定温度、压强下,气体体积由其分子数目的多少决定
【题目】自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:
KCl + Na![]() NaCl + K + Q (Q<0)
NaCl + K + Q (Q<0)
有关数据如下表:
熔点℃ | 沸点℃ | 密度 (g/cm3) | |
Na | 97.8 | 882.9 | 0.97 |
K | 63.7 | 774 | 0.86 |
NaCl | 801 | 1413 | 2.165 |
KCl | 770 | 1500 | 1.984 |
(1)请结合平衡移动理论分析,为什么能用该反应制备金属钾。
_______________________________________。
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为_____℃,而反应的最高温度应低于_____℃。
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有__________。(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有_____________________。
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为![]() ________。
________。
【题目】钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为______________,其原子核外未成对电子有_____个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为____堆积(填堆积方式),其中钛原子的配位数为________。

(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为______晶体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因_________________________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为___________。
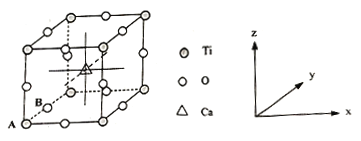
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________。