题目内容
已知下列热化学方程式:
2Zn(s)+O2(g) = 2ZnO(s) ΔH=-702.2 kJ·mol-1
Hg(l)+1/2O2(g) = HgO(s) ΔH=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s) = ZnO(s)+Hg(l)的反应热ΔH为( )
2Zn(s)+O2(g) = 2ZnO(s) ΔH=-702.2 kJ·mol-1
Hg(l)+1/2O2(g) = HgO(s) ΔH=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s) = ZnO(s)+Hg(l)的反应热ΔH为( )
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 |
| C.-611.5 kJ·mol-1 | D.+520.8 kJ·mol-1 |
A
试题分析:根据盖斯定律可知,目标方程式可由已知的方程式①×1/2-②得来,所以ΔH=(-702.2×1/2+90.7) kJ·mol-1 =-260.4 kJ·mol-1 ,所以选A。

练习册系列答案
相关题目

 N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1






 2NO(g)
2NO(g)  H>0
H>0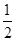 H2(g)+
H2(g)+  2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表: O2(g) = H2O(g) △H1
O2(g) = H2O(g) △H1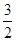 H2(g) = NH3 (g) △H3
H2(g) = NH3 (g) △H3 O2(g) =2NO2 (g) +3H2O(g) 的△H=
O2(g) =2NO2 (g) +3H2O(g) 的△H=